Table 1. Characteristics of the four sites analyzed in the province of Corrientes, land use and disturbance gradient. References: B: forest, PP: grazed pasture, PF: pasture with Pinus sp. seedlings, C: cotton crop.

TRABAJOS
Macrofauna edáfica en ecosistemas naturales y agroecosistemas de la eco-región Esteros del Iberá (Corrientes, Argentina)
Diego Fernano Gómez Pamies1; María Celina Godoy1* & Juan Manuel Coronel1
1 Laboratorio de Biología de los Invertebrados. Facultad de Ciencias Exactas y Naturales y Agrimensura, Universidad Nacional del Nordeste. Av. Libertad 5470, CP:
3400, Corrientes, Argentina.
*Autor para contacto: mcgodoy@exa.unne.edu.ar
Recibido: 06-07-15
Recibido con revisiones: 20-12-15
Aceptado: 20-12-15
RESUMEN
Se analizó la macrofauna del suelo de cuatro ambientes naturales y agroecosistemas localizados en zonas altas de la eco-región Esteros del Iberá (Corrientes, Argentina) con distintos grados de perturbación, a fin de contribuir a evaluar el impacto de las actividades productivas en este humedal. Se determinó la diversidad, abundancia, densidad y biomasa de los principales grupos y se compararon las comunidades analizadas. Se aplicó el protocolo de Conservación y Manejo Sustentable de la Biodiversidad del Suelo modificado, en cuatro puntos en cada sitio. Se analizó la influencia de distintos factores de perturbación sobre la biota. La macrofauna del suelo estuvo integrada por 19 órdenes de invertebrados, principalmente oligoquetos terrestres y artrópodos, entre los cuales las termitas, hormigas y coleópteros fueron los más abundantes. Las diferencias entre los ensambles analizados se evidenciaron en su composición taxonómica, diversidad, número de órdenes y densidad de los grupos más abundantes, pero ellas no fueron estadísticamente significativas para esta última característica. La mayoría de los individuos se detectaron en el estrato superficial del suelo (0-10 cm) y la biomasa fue más elevada en los pastizales aunque los órdenes de mayor biomasa relativa fueron distintos en cada sitio. Las similitudes entre ambientes agruparon por un lado al cultivo de algodón y al pastizal forestado, y por otro al bosque y al pastizal sometido a pastoreo. Dos de las perturbaciones ambientales analizadas (reemplazo de la vegetación natural y remoción del suelo) influyeron sobre las comunidades macroedáficas. Las hormigas y lombrices resultaron posibles invertebrados bioindicadores en estas comunidades, en tanto que las termitas subterráneas resultaron importantes por su diversidad y biomasa, principalmente en los dos ambientes con mayor grado de perturbación.
Palabras clave: Invertebrados del suelo; Agroecosistemas; Perturbaciones antrópicas.
Soil macrofauna in natural ecosystems and agroecosystems of the ibera wetlands ecoregion (Corrientes, Argentina)
ABSTRACT
Soil macrofauna from four natural and agricultural ecosystems with different disturbance degrees, located at the Esteros del Ibera ecoregion (Corrientes, Argentina) was analyzed in order to assess the impact of productive activities in this wetland. The diversity, abundance, density and biomass of the main invertebrate groups were determined and the analyzed communities were compared. The modified Conservation and Sustainable Management of Below Ground Biodiversity protocol was applied at four points on each site. The influence of different perturbation factors on the biota was analyzed. Soil macrofauna was composed by 19 invertebrate orders, mainly earthworms and arthropods (termites, ants and beetles were the most abundant). The differences between the analyzed assemblages were referred to taxonomic composition, diversity, order number and density, but they were not statistically significant for the last feature. Most individuals were detected in surface soil layer (0-10 cm) and biomass was higher on pastures although the orders of higher relative biomass were different at each site. On the bases of the similarities in the macrofaunal communities, the analyzed ecosystems formed two groups: cotton crop -forested pasture and natural forest- grazed pasture. Two of the analyzed perturbations (replacement of natural vegetation and soil removal) influenced the soil macrofauna. Ants and worms were identified as potential bioindicators in these assemblages, while subterranean termites were well represented, mainly in the more disturbed sites.
Key words: Soil invertebrates; Agroecosystems; Anthropogenic disturbances.
INTRODUCCIÓN
La biota del suelo regula procesos fundamentales como
la descomposición, mineralización y reciclaje de nutrientes
e influye en la fertilidad, por lo que se considera un recurso
que debe ser protegido y manejado adecuadamente
(Brussaard et al., 1997; Lavelle et al., 1997; Bignell & Eggleton,
2000; Swift & Bignell, 2001; Wolters, 2001; Lavelle et al.,
2006; Rossi et al., 2006; Brussaard et al., 2007; Jouquet et al., 2011). Diversos factores que producen alteraciones del
suelo pueden llevar a que especies que en él habitan se
extingan localmente o que otras aumenten su número
(Jordan et al., 1997; Brown et al., 2003; Blanchart et al., 2006;
Brévault et al., 2007; Ayuke et al., 2011).
Algunos grupos de organismos del suelo son considerados buenos indicadores de estas alteraciones, como los
nemátodes, ácaros, isópodos, hormigas, termitas subterráneas, etc. (de Souza & Brown, 1994; Scheu & Schulz,
1996; Bedano & Ruf, 2010; Rousseau et al., 2013; Zhao et al., 2013). Particularmente, la macrofauna y mesofauna
del suelo pueden verse afectadas por diferentes prácticas
agrícolas como cultivos anuales o pasturas extensivas e
intensivas, por lo que resulta de utilidad de manejar sus
poblaciones a fin de mantener y mejorar la fertilidad. En
particular, en áreas donde los campesinos tienen acceso
limitado a las modernas tecnologías productivas, tales como
algunas zonas de África, América Central y América del Sur
incluyendo áreas rurales aisladas del nordeste argentino
(Matson et al., 1997; Radford et al., 2001; Nkem et al., 2002;
Benton et al., 2003; Bedano et al., 2006; Brussaard et al.,
2007; Renard et al., 2013; Domínguez et al., 2014).
A nivel mundial, existen numerosos análisis de la macrofauna del suelo en distintos sistemas naturales y agrícolas, ya sea considerando el conjunto de todos los taxa presentes, o aquellos enfocados específicamente hacia un grupo
en particular, pero corresponden principalmente a zonas
tropicales y templadas como Amazonia, América Central,
Australia, Europa y África subsahariana (de Souza & Brown,
1994; Scheu & Schulz, 1996; Lobry de Bruyn, 1997; Ayuke et al., 2011; Rousseau et al., 2013). En la Argentina, los estudios referidos a la macrofauna en ecosistemas naturales
y antropizados se restringen a algunas regiones del país como la Pampeana o se enfocan generalmente en un grupo
taxonómico en particular, como lombrices de tierra (Momo et al., 1993; Clemente et al., 2003; López et al., 2005;
Domínguez et al., 2009; Masín et al., 2011), hormigas
(Folgarait et al., 1994; Bestelmeyer & Wiens, 1996; Bes-telmeyer, 2000; Theunis et al., 2005; Delsinne et al., 2007;
Farji-Brener, 2010; Cerda et al., 2012) y coleópteros (Marasas et al., 1997). Aún se conoce poco en el país con respecto a
los efectos de los cultivos y la ganadería sobre la macrofauna
del suelo en conjunto y su valor como bioindicadores de
perturbaciones y degradación del suelo. Algunos análisis de
este tipo se han desarrollado en cultivos de trigo, maíz, soja
y pasturas de la provincia de Buenos Aires, Córdoba y Entre
Ríos sometidos a diferentes métodos de siembra, así como
en otros usos de la tierra (Marasas et al., 2001; Ríos de Saluso et al., 2001; Gizzi et al., 2009; Domínguez et al., 2010; Manetti et al., 2010; Domínguez et al., 2014).
Para la provincia de Corrientes en particular, se han detectado escasos estudios que analizan macrofauna del suelo
en conjunto en ecosistemas naturales y/o antropizados
(Folgarait et al., 2003; Thomas et al., 2004). Otros trabajos
en la zona se refieren particularmente a algunos grupos
taxonómicos como hormigas (Folgarait et al., 2002; Folgarait et al., 2007; Calcaterra et al., 2010a; Calcaterra et al.,
2010b), coleópteros (Bar et al., 2005) y termitas (Laffont et al., 2004; Laffont & Porcel, 2007; Torales et al., 2009).
Las áreas analizadas en este trabajo se sitúan en la ecoregión de los Esteros del Iberá (Burkart et al., 1999), el mayor
humedal argentino. Si bien tres de los sitios se hallan comprendidos en la Reserva Provincial Iberá, las tierras altas se
hallan sometidas a una presión creciente por las prácticas
agro-silvo-pastoriles que se desarrollan en ellas y amenazan la conservación de estas unidades de paisaje y los
servicios ecosistémicos que brindan (Neiff & Poi de Neiff,
2005).
Dada la creciente necesidad de profundizar la comprensión de los procesos ecológicos que tienen lugar en los
suelos comprendidos en áreas de humedales y de identificar bioindicadores de perturbaciones edáficas en estos
ambientes, el objetivo de este estudio fue el de evaluar el
impacto de los diferentes usos de la tierra en ecosistemas
de esta región mediante el análisis de la macrofauna edáfica y analizar su uso como potenciales indicadores biológicos de calidad de suelo en ellos. Con ese objetivo se caracterizó la macrofauna en distintos ecosistemas naturales y
alterados, determinando la diversidad, abundancia, densidad y biomasa de los principales grupos taxonómicos. En
particular se evaluó la abundancia relativa de las termitas
subterráneas en estas colectividades. Asimismo, se establecieron relaciones entre los diferentes usos de la tierra
y las comunidades edáficas analizadas.
MATERIALES Y MÉTODOS
Sitios de estudio
Los relevamientos se realizaron en el norte de la provincia
de Corrientes (Argentina) que posee clima mesotermal húmedo con temperaturas medias anuales de entre 19,5 ºC a 22 ºC,
según las zonas. Las temperaturas máximas absolutas oscilan
entre 40 ºC y 44 ºC y las mínimas absolutas entre -2 ºC y -4 ºC.
Las precipitaciones son abundantes y concentradas en otoño y
primavera. Los valores de precipitación media anual oscilan entre
1.200 mm y 1.400 mm en las áreas incluidas en este estudio
(Escobar et al., 1996).
Se seleccionaron cuatro sitios en tres localidades, correspondientes a ambientes naturales y agroecosistemas cuyas características se presentan en la Tabla 1. Para cada sitio se registraron las coordenadas geográficas y se los caracterizó considerando las unidades de paisaje y vegetación (Carnevali, 1994),
los tipos de suelo (MPT-INTA, 2014) y la presencia de distintos
factores derivados de la intervención antrópica. De acuerdo a
sus características se estableció un gradiente de alteración de
ecosistemas analizados. Así, se consideró al bosque higrófilo (B),
situado en un área protegida, como el hábitat con menores modificaciones de origen antrópico y con la formación vegetal estructuralmente más compleja. Sometidos a un grado creciente de perturbación se hallaron el pastizal pastoreado (PP) y el pastizal
con una forestación reciente de Pinus L. sp. (PF). En el cultivo de
algodón (C) se registraron los factores de disturbio más intensos,
por lo que se consideró el ambiente más perturbado.
Tabla 1. Características de los cuatro sitios analizados de la provincia de Corrientes, usos de la tierra y gradiente de perturbación. Referencias: B:
bosque, PP: pastizal pastoreado, PF: pastizal con plantines de Pinus sp., C: cultivo de algodón.
Table 1. Characteristics of the four sites analyzed in the province of Corrientes, land use and disturbance gradient. References: B: forest, PP: grazed
pasture, PF: pasture with Pinus sp. seedlings, C: cotton crop.

Método de muestreo
Se aplicó una modificación del protocolo CSM-BGBD
(Conservación y Manejo Sustentable de la Biodiversidad del
Suelo) recomendado para ecosistemas tropicales (Moreira et al., 2012). El mismo comprende la delimitación de un cuadrado de 100 m de lado en cada sitio seleccionado. En cada vértice
del cuadrado se delimitó una columna de suelo o monolito de
25x25 cm de superficie, rodeado de una zanja de 30 cm de
profundidad. Las capas del suelo de cada monolito se extrajeron sucesivamente, en tres etapas (0-10, 10-20 y 20-30 cm de
profundidad). El suelo correspondiente a cada capa fue revisado minuciosamente y los ejemplares se recolectaron con pinzas
de punta fina y pinceles. Los invertebrados fueron con-servados
en etanol al 70% y etiquetados para su traslado al laboratorio,
donde se procedió a su examen bajo microscopio estereoscópico
e identificación. Asimismo, se estimó la biomasa de los especímenes, registrando su peso en laboratorio con una balanza de
precisión (error= 0,005 g) luego de secarlos parcialmente bajo
una luz intensa (método blotting) (Swift & Bignell, 2001).
Análisis taxonómico y estadístico
El análisis taxonómico y estadístico general se realizó a nivel
de orden y familia, ya que la riqueza de taxones de alto rango
es considerado un buen indicador de diversidad en distintos grupos
de invertebrados del suelo como nemátodes e insectos
(Ekschmitt et al., 2003). Para la identificación del material biológico se utilizaron claves y descripciones referidas a cada grupo
analizado (Quintero & Aiello, 1992; Morrone, 1996; Daly et al.,
1998; Morrone & Coscarón, 1998; Lawrence et al., 1999a; Lawrence et al., 1999b; Brusca & Brusca, 2003; Carbonell et al., 2004;
Coleman et al., 2004; Claps et al., 2008). Las determinaciones
taxonómicas de hormigas y termitas se realizaron a nivel de géneros y especies (Constantino, 1999; Palacio & Fernández, 2003;
Scheffrahn, 2013).
Los dendrogramas de similaridad de ambientes se construyeron mediante el método UPGMA. Para el análisis de similitud
entre los distintos ambientes no se incluyeron los órdenes que
se registraron solo en uno de ellos. Se calcularon las densidades
(ind m-2) de los órdenes de mayor representación. La significancia
estadística de las diferencias observadas entre los sitios de
muestreo y la influencia de las variables ambientales sobre la fauna edáfica se analizaron mediante el análisis de la varianza
no paramétrico de Kruskal- Wallis. Para la comparación de las
densidades de individuos entre pares de sitios se utilizó la prueba U de Mann Withney, como prueba a posteriori en los casos
en que el análisis de Kruskal- Wallis resultó positivo. Se utilizaron los software EstimateS 8.2 (Colwell, 2006) y PAST (Hammer et al., 2001). Todas las pruebas se realizaron con una significancia
de α= 0,05.
RESULTADOS Y DISCUSIÓN
El análisis de la estructura taxonómica y funcional de la macrofauna en los cuatro sitios analizados permitió registrar 19 órdenes de invertebrados, con un total de 1.793 individuos (Tabla 2). Las comunidades edáficas relevadas se hallaron constituidas predominantemente por diferentes grupos de artrópodos y, en menor número, por lombrices de tierra (Annelida, Oligochaeta). Valores elevados de diversidad y abundancia de estos dos grupos en la fauna del suelo han sido registrados previamente en ambientes tropicales y subtropicales de distintas regiones biogeográficas (Lobry de Bruyn, 1997; Barros et al., 2002; De la Rosa & Negrete-Yankelevich, 2012).
Tabla 2. Abundancia y número de órdenes de invertebrados detectados en las comunidades
edáficas de los cuatro sitios analizados. Referencias: B: bosque, PP: pastizal pastoreado,
PF: pastizal con plantines de Pinus sp., C: cultivo de algodón, N: número de individuos,
NO: número de órdenes.
Table 2. Invertebrate orders detected in the soil communities of the four study sites,
abundance and richness at each site and total values. References: B: forest, PP: grazed
pasture, PF: pasture with Pinus sp. seedlings, C: cotton crop, N: number of individuals,
NO: number of orders.

El esfuerzo de muestreo permitió capturar entre el
66,67% (B) y el 81,63% (PF) de los órdenes integrantes
de la macrofauna, con valores intermedios para C (74,29%)
y PP (78,05%).
Los órdenes registrados pertenecen a las Clases
Oligochaeta (1), Chilopoda (2), Diplopoda (2), Arachnida
(3) e Insecta (11). Cinco de los órdenes hallados (Tabla 2),
estuvieron presentes en los cuatro sitios de muestreo
(26,3%) y corresponden en general, a taxones de alta
diversidad y abundancia en el suelo como coleópteros,
hormigas, lombrices y termitas. Por el contrario, seis de ellos
se detectaron sólo en uno de los ambientes, tratándose en
estos casos de artrópodos pequeños, generalmente poco
numerosos, que pasan toda su vida (Pseudoscorpionida,
Dermaptera, Psocoptera, Julida) o parte de la misma
(Neuroptera) en la hojarasca o en el suelo (Daly et al., 1998).
Las termitas (Isoptera) fueron el grupo taxonómico con
mayor representación numérica total, ya que constituyeron el 53,57% del total de los individuos recolectados (Fig.
1). Se hallaron cinco géneros de termitas (Tabla 3), cada uno de los cuales estuvo representado por una sola especie. Los géneros Anoplotermes Mueller y Grigiotermes Mathews fueron los que registraron mayor ocurrencia. Los
himenópteros, principalmente de la familia Formicidae
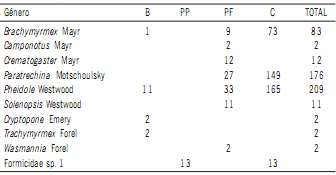
mostraron asimismo elevada abundancia (Fig. 1). Se registraron nueve géneros de hormigas, siendo los más abundantes Pheidole Westwood, Paratrechina Motschoulsky y Brachymyrmex Mayr (Tabla 4). En diferentes sistemas de
uso de la tierra en Nicaragua, las hormigas y termitas
constituyeron asimismo más del 85% de la macrofauna
recolectada (Rousseau et al., 2013). Si bien en distintos
análisis de ensambles de insectos sociales se considera
adecuada la utilización del número de colonias o de hallazgos de cada especie como indicador de abundancia (Jones& Eggleton, 2000; Ekschmitt et al., 2003; Leponce et al.,
2004; Vasconcellos et al., 2010), en este trabajo se consideró el número de individuos presentes de hormigas y
termitas para esta estimación, lo cual posibilitó la realización de un análisis conjunto con los demás grupos integrantes de la macrofauna. Este enfoque es aplicado asimismo en otros estudios referidos a estas comunidades (Barros et al., 2004; Rossi et al., 2006; Rousseau et al., 2013).

Figura 1. Abundancia relativa total de los órdenes de invertebrados detectados en los cuatro sitios analizados.
Figure 1. Total relative abundance of the invertebrate orders found in the four analyzed sites.
Tabla 3. Determinación taxonómica y abundancia de termitas (Isoptera, Termitidae) en los cuatro sitios analizados.
Referencias como en Tabla 2.
Table 3. Taxonomic determination and abundance of termites (Isoptera, Termitidae) in the four analyzed sites. References
as in Table 2.

Tabla 4. Determinación taxonómica y abundancia de hormigas (Hymenoptera, Formicidae)
en los cuatro sitios analizados. Referencias como en Tabla 2.
Table 4. Taxonomic determination and abundance of ants (Hymenoptera, Formicidae)
in the four analyzed sites. References as in Table 2.
El orden Coleoptera estuvo representado por diez familias, de las cuales Histeridae, Curculionidae y Staphylinidae mostraron mayor abundancia (Tabla 5). Se registraron también ocurrencias de otros artrópodos en menor número, como arácnidos y miriápodos, pero no superaron el 1% del total de individuos. El único grupo de invertebrados no artrópodos, los oligoquetos terrestres del orden Haplotaxida, representaron el 5,9% de los especímenes hallados.
Tabla 5. Determinación taxonómica y abundancia de coleópteros (Coleoptera) en los cuatro
sitios analizados. Referencias como en Tabla 2.
Table 5. Taxonomic determination and abundance of beetles (Coleoptera) in the four
analyzed sites. References as in Table 2.

En las comunidades analizadas se reconocieron cuatro
grupos funcionales de la biota del suelo: los herbívoros de
raíces, los ingenieros de ecosistemas, los descomponedores
y los depredadores (Brussaard, 1998). Entre los insectos
fitófagos que se alimentan de raíces se detectaron larvas
de diferentes familias de coleópteros como Curculionidae
y Scarabaeidae y grillos topo de la familia Gryllotalpidae
(Orthoptera). Los ingenieros de ecosistemas (lombrices,
hormigas, termitas) son organismos mayores que, con sus
actividades, alteran el medio físico que los rodea y afectan
directa o indirectamente la disponibilidad de recursos para otros, generalmente más pequeños, creando o modificando el hábitat con sus estructuras biogénicas (túneles, nidos,
etc.) y sus movimientos a través del suelo. Los descomponedores o transformadores de hojarasca (diplópodos,
larvas de insectos, etc.) participan de la degradación física y
química del material vegetal en descomposición pero sin la
creación de nuevas estructuras. Estos transformadores y
otros invertebrados menores dependen en gran medida de
la acción de los ingenieros (Bignell, 2006). Entre los depredadores hallados se mencionan arañas, pseudoescorpiones y coleópteros de las familias Carabidae, Coccinellidae
e Histeridae, cuya presencia es indicativa de redes tróficas
complejas, a la vez que contribuyen al control de plagas enáreas agrícolas (Daly et al., 1998; Gullan & Cranston, 2000;
Rousseau et al., 2013). Los resultados de este trabajo difieren de otros en praderas naturales y áreas de siembra directa en Córdoba, así como en pastizales y campos de arroz
abandonados de Corrientes, donde los ingenieros de ecosistemas también se hallaron presentes, pero sólo hormigas y lombrices mostraron abundancias significativas, en
tanto que los isópteros fueron escasos (Folgarait et al.,
2003; Domínguez et al., 2010).
Con respecto a la distribución vertical de la fauna, el
número de individuos por estrato resultó inversamente
proporcional a la profundidad. Así, el estrato superior (0-10 cm) albergó el mayor número de invertebrados en todos
los ambientes (entre el 45 y 58% de los individuos), el
estrato medio (10- 20 cm) entre el 29 y el 39% y el estrato
inferior (20-30 cm) resultó el menos poblado, con el 13
al 20%. La distribución decreciente con la profundidad
resultó similar en las cuatro áreas analizadas, concordando con otros análisis realizados en Corrientes (Folgarait et al., 2003; Thomas et al., 2004) y la Amazonia brasilera
(Barros et al., 2002) donde la localización vertical de la fauna
mantuvo estos patrones generales, aunque con variaciones menores entre los distintos usos de la tierra.
Al realizar un análisis comparativo entre sitios, el dendrograma obtenido (Fig. 2) indicó que B y PP tienen mayor
afinidad entre sí en su macrofauna y que C se relaciona más
con PF que con los restantes ambientes. Estos hallazgos
permitieron agrupar a los ambientes con menores y mayores grados de perturbación, respectivamente.

Figura 2. Dendrograma de similaridad de ambientes obtenido con el índice de similitud de Bray-Curtis. Referencias: B: bosque, PP: pastizal con plantines
de Pinus sp., PF: pastizal forestado, C: cultivo de algodón.
Figure 2. Environments similarity dendrogram obtained by the Bray-Curtis similarity index. References: B: forest, PP: grazed pasture, PF: pasture withPinus sp. seedlings, C: cotton crop.
Los cuatro sitios registraron diferencias entre sí en los grupos taxonómicos con mayor abundancia (Fig. 3), densidad (Tabla 6) y biomasa (Fig. 4). En tres de los ambientes analizados (B, PF y C) se registró mayor abundancia y densidad de termitas, seguidas de himenópteros y coleópteros, en tanto que, en el sitio sometido a pastoreo (PP) el grupo que predominó en ambos aspectos fueron los oligoquetos terrestres y se ubicaron a continuación coleópteros e himenópteros. En PP, el número de himenópteros e isópteros por unidad de superficie resultó menor que en los otros ambientes. Sin embargo, estas diferencias observadas no resultaron estadísticamente significativas (Tabla 6). Las mayores densidades de la macrofauna se asocian en muchos casos a sistemas con menor grado de disturbio, tal como se ha reportado para la región pampeana (Gómez et al., 1996; Gizzi et al., 2009). Sin embargo, en el presente estudio los mayores valores se detectaron en los ambientes más perturbados (C, PF y PP), principalmente para termitas y hormigas. También en arroceras abandonadas de Corrientes se ha observado un aumento muy notable de las densidades de hormigas Camponotus punctulatus Mayr y lombrices, en comparación con pastizales naturales del área, debido a las fuertes perturbaciones ocasionadas por el cultivo de arroz irrigado (Folgarait et al., 2003; Thomas et al., 2004).

Figura 3. Abundancia de los cuatro órdenes mejor representados en cada ambiente. Referencias: B: bosque, PP: pastizal pastoreado, PF: pastizal
con plantines de Pinus sp., C: cultivo de algodón, N: número de individuos.
Figure 3. Abundance of the four best represented orders found at each site. References: B: forest, PP: grazed pasture, PF: pasture with Pinus sp.
seedlings, C: cotton crop, N: number of individuals.
Tabla 6. Densidad media estimada (ind/m2) y desvío estándar (sd) de los cuatro órdenes más representativos en bosque (B),
pastizal pastoreado (PP), pastizal con plantines de Pinus sp. (PF) y cultivo de algodón (C). Diferencias significativas: (*), prueba
de Kruskal- Wallis (p<0,05).
Table 6. Estimated mean density (ind/m2) and standard deviation (sd) of the most representative orders in forest (B), grazed
pasture (PP), pasture with Pinus sp. seedlings (PF) and cotton crop (C). Significant differences (*), Kruskal-Wallis test (p <0.05).


Figura 4. Biomasa estimada (g/m2) en los cuatro ambientes analizados. Referencias: B: bosque, PP: pastizal pastoreado, PF: pastizal con plantines
de Pinus sp., C: cultivo de algodón.
Figure 4. Estimated biomass (g/m2) in the four sites. References: B: forest, PP: grazed pasture, PF: pasture with Pinus sp. seedlings, C: cotton crop.
La complementariedad entre los sitios, analizada mediante el examen de las comunidades de insectos sociales,
resultó elevada, con valores iguales o mayores a 0,5. Al
comparar el ambiente menos alterado (B) con el más perturbado (C), el 50% de las especies de termitas y el 60%
de los géneros de hormigas resultaron diferentes. Las discrepancias más notables en la composición de especies y
géneros se registraron entre B y PF, con 78% y 80% de
especies y géneros complementarios en los ensambles de
termitas y hormigas, respectivamente.
Precisamente, PF present ó la mayor diversidad de hormigas (siete géneros) y termitas (cinco especies) (Tablas 3 y 4). Pese a tratarse de un ambiente perturbado, la presencia
de abundantes recursos orgánicos como plantines de Pinus sp. y restos de vegetación natural removida durante la plantación, pudieron favorecer la colonización y establecimiento de algunos grupos dominantes, como distintos géneros
de hormigas y termitas (Barros et al., 2002). Otra perturbación importante en la zona del Iberá, el pastoreo de ganado,
parece también promover una mayor abundancia y biomasa
de hormigas, al menos de algunas especies y grupos funcionales en particular (Calcaterra et al., 2010b).
La biomasa total de la macrofauna capturada en los
distintos ambientes, result ó mayor en ambos pastizales que
en B y C, con estimaciones por unidad de superficie que
variaron entre 3,3 g m-2 en B y 52,92 g m-2 en PP (Fig. 4).
Los mayores aportes correspondieron a diferentes grupos
de invertebrados en los ambientes analizados. En ambos
pastizales, la mayor proporción de la biomasa correspondió al grupo más abundante y de mayor densidad de cada
uno: Isoptera en PF (12,88 g m-2) y Oligochaeta (48,98 g
m-2) en PP. En los otros dos sitios, fue el orden Coleoptera
quien aportó la mayor cantidad de biomasa: 3,00 g m-2 en
C y 2,26 g m-2 en B. Los valores totales de biomasa en PP y PF superan a los registrados en sabanas nativas de Colombia, no alteradas (15,3 gm-2) y bajo régimen de pastoreo (16,8
gm-2) y los grupos dominantes (lombrices y termitas) concuerdan (Decaëns et al., 2004). El mencionado análisis
reporta la alteración de las comunidades macrofaunales enáreas pastoreadas, donde se observó un marcado aumento
de la biomasa relativa de lombrices y una disminución de la
de termitas, por lo que la elevada biomasa de oligoquetos
observada en PP podría ser una consecuencia de estas actividades ganaderas, que parecerían resultar benéficas para
estos anélidos y ejercer un efecto negativo sobre las comunidades de isópteros (James, 1988; Decaëns et al., 2004).
Por el contrario, otras prácticas agrícolas como la siembra directa resultan perjudiciales para sus poblaciones
(Domínguez et al., 2009; Domínguez et al., 2010). Asimismo, su baja densidad en el cultivo podría deberse, entre
otros factores, a la aplicación de agroquímicos que afectan
significativamente a las poblaciones de lombrices
(Domínguez et al., 2009; Domínguez et al., 2010; Pelosi et al., 2014).
En otros ambientes, como selvas tropicales de América
Latina, la biomasa de la macrofauna varía entre 14 a 54 g
m-2 (Lavelle & Kohlman, 1984; Lavelle & Pashanasi, 1989;
Decaëns et al., 1994; Decaëns et al., 2004) y se halla
constituida principalmente por lombrices en la mayoría de
los sitios estudiados. El elevado registro de biomasa de
termitas subterráneas en PF, resultó mayor a numerosas
estimaciones correspondientes a ambientes de sabanas y
bosques tropicales y subtropicales, incluso de diversas
selvas lluviosas. Por el contrario, el menor valor registrado
en C (1,68 gm»2) se asemeja a los detectados en otras áreas
de cultivo, como campos de maíz y pasturas en África
(Bignell & Eggleton, 2000).
Result ó inesperada la escasa diversidad, abundancia y
biomasa de macrofauna en el bosque analizado, ya que tales
ambientes suelen presentar elevados valores y son considerados beneficiosos para la salud del suelo en general
y la fauna edáfica en particular, más aún por estar situado
dentro de un área protegida. Entre los posibles factores que
influirían en tales resultados pueden mencionarse algunas particularidades del ambiente, como una marcada
heterogeneidad espacial que influye en la distribución y
abundancia de los organismos del suelo. Tales características requieran probablemente un esfuerzo de muestreo
elevado, como en pasturas de zonas tropicales en Brasil,
a fin de proveer estimaciones acertadas de la riqueza y
diversidad de la macrofauna (Rossi et al., 2006).
Con respecto a la influencia de los factores ambientales de origen antrópico sobre la fauna edáfica de los ambientes analizados (Tabla 7), los resultados mostraron que
el reemplazo de la vegetación natural afectó de manera
significativa el número total de órdenes de la macrofauna
y la densidad de himenópteros. Por su parte, la remoción
del suelo perturbó de manera significativa a las lombrices,
pero no a los otros grupos analizados. En otros ambientes
de la Reserva Iberá, el pastoreo parece no ser un factor que
afecte significativamente a la diversidad de hormigas,
aunque sí selectivamente a algunos grupos como se
mencionó anteriormente (Calcaterra et al., 2010b). No se
evidenciaron diferencias significativas en los sitios analizados con respecto al uso de agroquímicos. Estos hallazgos confirman que los factores de perturbación pueden
ejercer una influencia diferencial sobre los distintos grupos funcionales del suelo, como en ensambles de artrópodos de la superficie donde los depredadores resultaron
más afectados que los fitófagos (Marasas et al., 2001).
Tabla 7. Influencia de las variables ambientales sobre la fauna edáfica analizada: RV: reemplazo de la vegetación natural, RS: remoción
del suelo por pisoteo y agricultura, UA: uso de agroquímicos. Diferencias significativas: (*), prueba de Kruskal- Wallis (p<0,05).
Table 7. Influence of environmental variables on the analyzed soil fauna: RV: replacement of natural vegetation, RS: removal of
soil by trampling and agriculture, UA: agrochemicals. Significant differences (*), Kruskal-Wallis test (p <0.05).

Los taxones que mostraron mayor susceptibilidad ante estos cambios (hormigas y lombrices) resultan de inter és como potenciales bioindicadores de perturbación y de calidad del suelo a escala local en los ambientes analizados de la eco- región Iberá, tal como ha sido registrado en otros estudios para estos grupos de organismos (Lobry de Bruyn, 1997; Barros et al., 2002; Brown et al., 2003; Mathieu et al., 2005; Rousseau et al., 2013).
CONCLUSIONES
Los resultados presentados aquí aportan datos que contribuyen a la evaluación del impacto de actividades productivas en áreas protegidas de la eco-región de los Esteros del Iberá. La fauna del suelo en general, estuvo integrada por artrópodos (termitas, hormigas y coleópteros) y lombrices de tierra. Se observaron diferencias en los ensambles de invertebrados edáficos de los sitios analizados, en su composición taxonómica, diversidad y densidad de los grupos más abundantes, pero ellas no fueron estadísticamente significativas para esta última característica. Las similitudes entre ambientes agruparon entre sí al cultivo y al pastizal forestado, y por otra parte al bosque y al pastizal pastoreado. Los valores de biomasa fueron mayores en pastizales y los órdenes de mayor biomasa relativa fueron distintos en cada sitio. El reemplazo de la vegetación natural y la remoción del suelo en los ambientes analizados, influyeron sobre la densidad de las comunidades edáficas. Se detectaron como posibles invertebrados bioindicadores a hormigas y lombrices, en tanto que las termitas subterráneas constituyeron un grupo importante de la fauna edáfica, principalmente en los dos sitios más perturbados.
AGRADECIMIENTOS
A los integrantes del Laboratorio de Biología de los Invertebrados (FaCENA, UNNE) por su colaboración en los trabajos de campo. Por el asesoramiento en las identificaciones, a M.O. Arbino y D. Larrea (hormigas), G. Avalos (arañas) y M. Damborsky (coleópteros). Trabajo financiado por la Secretaría General de Ciencia y Tecnología de la UNNE.
BIBLIOGRAFÍA
1. Ayuke, FO; MM Pullemana; B Vanlauweb; RGM de Goedea; J Sixc; C Csuzdid & L Brussaard. 2011. Agricultural management affects earthworm and termite diversity across humid to semi-arid tropical zones. Agr. Ecosyst. Environ. 140: 148-154.
2. Bar, ME; MP Damborsky; G Avalos; E Monteresino & EB Oscherov. 2005. Fauna de Arthropoda de la Reserva Iberá, Corrientes, Argentina. En: FG Aceñolaza (ed.). Temas de la Biodiversidad del Litoral fluvial argentino. Vol. 2. pp. 293-310. INSUGEO, Miscelánea, 14. Tucumán, Argentina. 550 pp.
3. Barros, E; B Pashanasi; R Constantino & P Lavelle. 2002. Effects of land-use system on the soil macrofauna in western Brazilian Amazonia. Biol. Fertil. Soils 35:338-347.
4. Bedano, JC & A Ruf. 2010. Sensitivity of different taxonomic levels of soil Gamasina to land use and anthropogenic disturbances. Agric. For. Entomol. 12: 203-212.
5. Bedano, JC; MP Cantu & ME Doucet. 2006. Influence of three different land management practices on soil mite (Arachnida: Acari) densities in relation to a natural soil. Appl. Soil Ecol. 32: 293-304.
6. Benton, TG; J Vickery & J Wilson. 2003. Farmland biodiversity: is habitat heterogeneity the key? Trends Ecol. Evol. 18: 182-188.
7. Bestelmeyer, BT. 2000. The trade-off between thermal tolerance and behavioural dominance in a subtropical South American ant community. J. Anim. Ecol. 69: 998-1009.
8. Bestelmeyer, BT & J Wiens. 1996. The effects of land use on the structure of groundforaging ant communities in the Argentinean Chaco. Ecol. Appl. 6: 1225-1240.
9. Bignell, D. 2006. Termites as soil engineers and soil processors. En: H König & A Varma (eds). Intestinal Microorganisms of Termites and Other Invertebrates. pp. 183- 220. Soil Biology Series 6. Springer. 483 pp.
10. Bignell, D & P Eggleton. 2000. Termites in ecosystems. In: T Abe; D Bignell & M Higashi (eds.). Termites: Evolution, Sociality, Symbioses, Ecology. pp. 363-388. Kluwer Academic Publishers. 466 pp.
11. Blanchart, E; C Villenave; A Viallatoux; B Barthés; C Girardin; A Azontonde & C Feller. 2006. Long-term effect of a legume cover crop (Mucuna pruriens var. utilis) on the communities of soil macrofauna and nematofauna under maize cultivation in southern Benin. Eur. J. Soil. Biol. 42: 136-144.
12. Brévault, T; S Bikay; JM Maldès & K Naudin. 2007. Impact of a no-till with mulch soil management strategy on soil macrofauna communities in a cotton cropping system. Soil Till. Res. 97: 140-149.
13. Brown, GG; NP Benito; A Pfsini; KD Sautter; MF Guimarães & E Torres. 2003. No-tillage greatly increases earthworm populations in Paraná state, Brazil. Pedobiol. 47: 764-771.
14. Brusca, RC & GJ Brusca. 2003. Invertebrates. 2da edn. Sinauer Associated. Sunderland, USA. 936 pp.
15. Brussaard, L. 1998. Soil fauna, guilds, functional groups and ecosystem processes. Appl. Soil Ecol. 9: 123-135.
16. Brussaard, L; V Behan-Pelletier; D Bignell; V Brown; W Didden; PJ Folgarait; C Fragoso; DW Freckman; VV Gupta; S Hattori; D Hawksworth; C Klopatek; P Lavelle; D Malloch; J Rusek; B Söderström; J Tiedje & V Ross. 1997. Biodiversity and ecosystem functioning in soil. Ambio 26(8): 563-570.
17. Brussaard, L; P de Ruiter & G Brown. 2007. Soil biodiversity for agricultural sustainability. Agr. Ecosyst. Environ. 121: 233-244.
18. Burkart, R; NO Bárbaro; RO Sánchez & DA Gómez. 1999. Eco-regiones de la Argentina. Administración de Parques Nacionales. Secretaría de Recursos Naturales y Desarrollo Sustentable. Buenos Aires, Argentina. 42 pp.
19. Calcaterra, L; F Cuezzo; S Cabrera & J Briano. 2010a. Ground ant diversity (Hymenoptera: Formicidae) in the Iberá Nature Reserve, the largest wetland of Argentina. Ann. Entomol. Soc. Am. 103(1): 71-83.
20. Calcaterra, L; S Cabrera; F Cuezzo; I Jiménez Pérez & J Briano. 2010b. Habitat and grazing influence on terrestrial ants in subtropical grasslands and savannas of Argentina. Ann. Entomol. Soc. Am. 103(4): 635-646.
21. Carbonell, CS; MM Cigliano & CE Lange. 2006. Acridomorph (Orthoptera) species of Argentina and Uruguay/Especies de Acridomorfos (Orthoptera) de Argentina y Uruguay. CD-ROM. Publications on Orthopteran Diversity. The Orthopterists’ Society.
22. Carnevali, R. 1994. Fitogeografía de la provincia de Corrientes. Gobierno de la provincia de Corrientes- INTA. Corrientes, Argentina. 324 pp.
23. Cerda, NV; M Tadey; A Farji-Brener & MC Navarro. 2012. Effects of leaf-cutting ant refuse on native plant performance under two levels of grazing intensity in the Monte Desert of Argentina. Appl. Veg. Sci. 15: 479-487.
24. Claps, LE; G Debandi & S Roig-Juñent (Dir.). 2008. Biodiversidad de Artrópodos Argentinos. Vol. 2. Sociedad Entomológica Argentina. Tucumán, Argentina. 615 pp.
25. Clemente, NL; AN López; AM Vincini; HA Alvarez Castillo; DM Carmona; PL Manetti & S San Martino. 2003. Abundancia de megadrilos (Annelida: Oligochaeta) en diferentes sistemas de producción. Ci. Suelo 21:35-43.
26. Coleman, DC; DA Crossley & PF Hendrix. 2004. Fundamentals of soil ecology. 2da edn. Elsevier Academic Press. San Diego, USA. 408 pp.
27. Colwell, RK. 2006. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8.2. User’s Guide and application published at: http://purl.oclc.org/estimates. 22/4/15.
28. Constantino, R. 1999. Chave ilustrada para identificação dos gêneros de cupins (Insecta: Isoptera) que ocorrem no Brasil. Bol. Mus. de Zool. da Universidade de São Paulo 40:387-448.
29. Daly, HV; JT Doyen & AH Purcell. 1998. Introduction to insect biology and diversity. 2da edn. Oxford University Press. New York, USA. 680 pp.
30. Decaëns, T; P Lavelle; JJ Jiménez; G Escobar & G Rippstein. 1994. Impact of land management on soil macrofauna in the Oriental Llanos of Colombia. Eur. J. Soil Biol. 30: 157-168.
31. Decaëns,T; JJ Jiménez; E Barros; A Chauvel; E Blanchart; C Fragoso & P Lavelle. 2004. Soil macrofaunal communities in permanent pastures derived from tropical forest or savanna. Agr. Ecosyst. Environ. 103(2): 301-312.
32. De la Rosa, I & S Negrete-Yankelevich. 2012. Distribución espacial de la macrofauna edáfica en bosque mesófilo, bosque secundario y pastizal en la reserva La Cortadura, Coatepec, Veracruz, México. Rev. Mex. Biodivers. 83: 201-215.
33. Delsinne, T; M Leponce & Y Roisin. 2007. Spatial and temporal foraging overlaps in a Chacoan ground foraging ant assemblage. J. Arid. Environ. 71:29-44.
34. de Souza, OF & VK Brown. 1994. Effects of habitat fragmentation on Amazonian termite communities. J. Trop. Ecol. 10: 197-206.
35. Domínguez, A; JC Bedano & AR Becker. 2009. Cambios en la comunidad de lombrices de tierra (Annelida: Lumbricina) como consecuencia del uso de la técnica de siembra directa en el Centro- Sur de Córdoba, Argentina. Ci. Suelo 27(1): 11-19.
36. Domínguez, A; JC Bedano & AR Becker. 2010. Negative effects of no-till on soil macrofauna and litter decomposition in Argentina as compared with natural grasslands. Soil Till. Res. 110: 51-59.
37. Domínguez, A; JC Bedano; AR Becker & RV Arolfo. 2014. Organic farming fosters agroecosystem functioning in Argentinian temperate soils: Evidence from litter decomposition and soil fauna. Appl. Soil Ecol. 83: 170-176.
38. Ekschmitt, K; T Stierhoff; J Dauber; K Kreimes & V Wolters. 2003. On the quality of soil biodiversity indicators: abiotic and biotic parameters as predictors of soil faunal richness at different spatial scales. Agr. Ecosyst. Environ. 98: 273-283.
39. Escobar, EH; HD Ligier; R Melgar; H Matteio & O Vallejos. 1996. Mapa de Suelos de la Provincia de Corrientes (1:500.000). INTA. Corrientes, Argentina. 433 pp.
40. Farji- Brener, AG. 2010. Leaf-cutting ant nests and soil biota abundance in a semi-arid steppe of Northwestern Patagonia. Sociobiology 56(2): 549-557.
41. Folgarait, PJ; AG Farji- Brener & J Protomastro. 1994. Influence of biotic, chemical and mechanical plant defenses on the foraging pattern of the leaf-cutter ant Acromyrmex striatus in a subtropical forest. Ecologia Austral 4:11-17.
42. Folgarait, PJ; S Perelman; NB Gorosito; R Pizzio & J Fernández. 2002. Effects of Camponotus punctulatus ants on plant community composition and soil properties across land-use histories. PlantEcol. 163: 1-13.
43. Folgarait, PJ; N Gorosito; R Pizzio; JP Rossi & J Fernández. 2007. Camponotus punctulatus ant’s demography: a temporal study across land-use types and spatial scales. Insect. Soc. 54: 42-52.
44. Folgarait, P; F Thomas; T Desjardins; M Grimaldi; P Curmi; I Tayasu & PM Lavelle. 2003. Soil properties and the macrofauna community in abandoned irrigated rice fields of Northeastern Argentina. Biol. Fert. Soils 38: 349-357.
45. Gizzi, AH; HA Álvarez Castillo; PL Manetti; AN López; NL Clemente & GA Studdert. 2009. Caracterización de la meso y macrofauna edáfica en sistemas de cultivo del sudeste bonaerense. Ci. Suelo 27(1): 1-9.
46. Gómez, M; H Krüger & M Sagardoy. 1996. Actividad biológica en un suelo de la zona semiárida bonaerense cultivado con la secuencia soja-trigo bajo tres prácticas culturales. Ci. Suelo 14(1): 37-41.
47. Gullan, PJ & P Cranston. 2000. The Insects: An Outline of Entomology. 2da edn. Blackwell Science. Oxford, UK. 584 pp.
48. Hammer O; DA Harper & PD Ryan. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontol. Electron. 4: 1-9.
49. James, SW. 1988. The post fire environment and earthworm populations in tallgrass prairies. Ecology 62: 476-483.
50. Jones, D & P Eggleton. 2000. Sampling termite assemblages in tropical forest: testing a rapid biodiversity assessment protocol. J. Appl. Ecol. 37: 191-203.
51. Jordan, D; JA Stecker; VN Cacnio-Hubbard; FL Gantzer & JR Brown. 1997. Earthworm activity in no-tillage and conventional tillage systems in Missouri soils: A preliminary study. Soil Biol. Biochem. 29: 489-491.
52. Jouquet, P; S Traore; C Choosai; C Hartmann & D Bignell. 2011. Influence of termites on ecosystem functioning. Ecosystem services provided by termites. Eur. J. Soil Biol. 47(4): 215-222.
53. Laffont, ER & EA Porcel. 2007. Diversidad de termitas (Isoptera) en pastizales del nordeste de la provincia de Corrientes, Argentina. Rev. Colomb. Entomol. 33(1): 82-85.
54. Laffont, ER; GJ Torales; JM Coronel; MO Arbino & MC Godoy. 2004. Termite (Insecta, Isoptera) fauna from National Parks of the Northeast Region of Argentina. Sci. Agric. (61): 665-670.
55. Lavelle, P & B Kohlman. 1984. Etude quantitative de la macrofaune du sol dans une forêt tropicale humide du Mexique (Bonampak, Chiapas). Pedobiol. 27: 377-393.
56. Lavelle, P & B Pashanasi. 1989. Soil macrofauna and land management in Peruvian Amazonia (Yurimaguas, Loreto). Pedobiol. 33: 283-409.
57. Lavelle, P; D Bignell & M Lepage. 1997. Soil function in a changing world: the role of invertebrate ecosystem engineers. Eur. J. Soil Biol. 33: 159-193.
58. Lavelle, P; T Decaëns; M Aubert; S Barot; M Blouin; F Bureau; P Margerie; P Mora & JP Rossi. 2006. Soil invertebrates and ecosystem services. Eur. J. Soil Biol. 42: S3-S15.
59. Lawrence, JF; AM Hastings; MJ Dallwitz; TA Paine & EJ Zucher. 1999a. Beetles of the world: descriptions, illustrations, and information retrieval for families and subfamilies. CSIRO Publishing. Melbourne,Australia. CD-ROM, versión 1.1 para MSWindows.
60. Lawrence, JF; AM Hastings; MJ Dallwitz & TA Paine. 1999b. Beetle larvae of the world: descriptions, illustrations, and information retrieval for families and subfamilies. CSIRO Publishing. Melbourne,Australia. CD-Rom, versión 1.1. para MSWindows.
61. Leponce, M; L Theunis; J Delabie & Y Roisin. 2004. Scale dependence of diversity measures in a leaf–litter ant assemblage. Ecography 27: 253-267.
62. Lobry de Bruyn, LA. 1997. The status of soil macrofauna as indicators of soil health to monitor the sustainability of Australian agricultural soils. Ecol. Econ. 23: 167-178.
63. López, A; AM Vincini; NL Clemente; PL Manetti; DM Carmona & HA Álvarez Castillo. 2005. Densidad estacional y distribución vertical de los Enchytraeidae (Annelida: Oligochaeta) en diferentes sistemas de producción. Ci. Suelo 23(2):115-121.
64. Manetti, PL; AN López; NL Clemente & AJ Faberi. 2010. Tillage system does not affect soil macrofauna in southeastern Buenos Aires province, Argentina. Span. J. Agric. Res. 8(2): 377-384.
65. Marasas, ME; S Sarandón & A Cicchino. 1997. Efecto de la labranza sobre la coleopterofauna edáfica en un cultivo de trigo en la provincia de Buenos Aires (Argentina). Ci. Suelo 15: 59-63.
66. Marasas, ME; S Sarandón & A Cicchino. 2001. Changes in soil arthropod functional group in a wheat crop under conventional and no tillage systems in Argentina. Appl. Soil Ecol. 18: 61-68.
67. Masín, CE; AR Rodríguez & MI Maitre. 2011. Evaluación de la abundancia y diversidad de lombrices de tierra en relación con el uso del suelo en el cinturón hortícola de Santa Fe (Argentina). Ci. Suelo 29(1): 21-28.
68. Mathieu, J., JP Rossi; P Mora; P Lavelle; PF Martins; C Rouland & M Grimaldi. 2005. Recovery of Soil Macrofauna Communities after Forest Clearance in Eastern Amazonia, Brazil. Conserv. Biol. 19: 1598-1605
69. Matson, P; W Parton; A Power & M Swift. 1997. Agricultural intensification and ecosystem properties. Science 277: 504-509.
70. Ministerio de Producción y Trabajo de la Provincia de Corrientes & INTA. 2014. Gestor de Archivos Georreferenciados. Suelo-Aptitud Agricola. http://cartogis.corrientes.gov.ar/ home.php. 29/04/2015.
71. Momo, F; C Giovanetti & L Malacalza. 1993. Relación entre la abundancia de distintas especies de lombrices de tierra (Annelida, Oligochaeta) y algunos parámetros fisicoquímicos en un suelo típico de la estepa pampeana. Ecología Austral 3(1): 7-14.
72. Moreira, F; EJ Huising & DE Bignell. 2012. Manual de biología de suelos tropicales. Muestreo y caracterización de la biodiversidad bajo suelo. Instituto Nacional de Ecología. México. 337 pp.
73. Moreno, CE. 2001. Métodos para medir la biodiversidad. M&T-Manuales y Tesis. Vol 1. Sociedad Entomológica Aragonesa. Zaragoza, España. 84 pp.
74. Morrone, JJ. 1996. Clave ilustrada para la identificación de las familias sudamericanas de gorgojos (Coleptera: Curculionoidea). Rev. Chilena Ent. 23: 59-63.
75. Morrone, JJ & S Coscarón (Dir.). 1998. Biodiversidad de Artrópodos Argentinos. Una perspectiva biotaxonómica. Ediciones Sur. La Plata, Argentina. 599 pp.
76. Neiff, JJ & A Poi de Neiff. 2005. Situación ambiental en la ecorregión Iberá. En: A Brown; U Martínez Ortiz; M Acerbi & J Corcuera (eds). La situación ambiental Argentina 2005. Pp. 177-184. Fundación Vida Silvestre Argentina. Buenos Aires, Argentina.
77. Nkem, JN; L Lobry de Bruyn; N Hulugalle & C Grant. 2002. Changes in invertebrate populations over the growing cycle of an N-fertilised and unfertilised wheat crop in rotation with cotton in a grey Vertosol. Appl. Soil Ecol. 20(1): 69-74.
78. Palacio, EE & F Fernández. 2003. Claves para las subfamilias y géneros. En: F Fernández (ed.). Introducción a las hormigas de la región Neotropical. Pp. 233-260. Instituto Humboldt. Bogotá, Colombia. 424 pp.
79. Pelosi, C; S Barot; Y Capowiez; M Hedde & F Vandenbulcke. 2014. Pesticides and earthworms. A review. Agron. Sustain. Dev. 34: 199-228.
80. Quintero, D & A Aiello (eds). 1992. Insects of Panama and Mesoamerica: selected studies. Oxford University Press. New York, USA. 720 pp.
81. Radford, BJ; AC Wilson-Rummenie; GB Simpson; KL Bell & MA Ferguson. 2001. Compacted soil affects soil macrofauna populations in a semi-arid environment in central Queensland. Soil Biol. Biochem. 33: 1869-1872.
82. Renard, D; JJ Birk; A Zangerlé; P Lavelle; B Glaser; R Blatrix & D McKey. 2013. Ancient human agricultural practices can promote activities of contemporary non-human soil ecosystem engineers: A case study in coastal savannas of French Guiana. Soil Biol. Biochem. 62: 46-56.
83. Ríos de Saluso, ML; A Saluso; O Paparotti & C Debona. 2001. Asociación entre la macrofauna del suelo y la siembra directa en el oeste de Entre Ríos. En: Panigatti, JL; D Buschiazzo & H Marelli (eds). Siembra Directa II. Pp. 83-95. INTA.
84. Rossi, JP; J Mathieu; M Cooper & M Grimaldi. 2006. Soil macrofaunal biodiversity in Amazonian Pastures: Matching sampling with Patterns. Soil Biol. Biochem. 38:2178-2187.
85. Rousseau, L; S Fonte; O Téllez; R van der Hoekc & P Lavelle. 2013. Soil macrofauna as indicators of soil quality and land use impacts in smallholder agroecosystems of western Nicaragua. Ecol. Indic. 27: 71-82.
86. Scheffrahn, R. 2013. Compositermes vindai (Isoptera: Termitidae: Apicotermitinae), a new genus and species of soldierless termite from the Neotropics. Zootaxa 3652(3): 381-391.
87. Scheu, S & E Schulz. 1996. Secondary succession, soil formation and development of a diverse community of oribatids and saprophagous soil macroinvertebrates. Biodivers. Conserv. 5: 235-250.
88. Swift, M & D Bignell. 2001. Standard methods for the assessment of soil biodiversity and land-use practice. ASB-Lecture Note 6B. International Centre for Research in Agroforestry, South East Asian Regional Research Programme Bogor, Indonesia. 34 pp.
89. Theunis, L; M Gilbert; Y Roisin & M Leponce. 2005. Spatial structure of litter-dwelling ant distribution in a subtropical dry forest. Insect. Soc. 52: 366-377.
90. Thomas, F.; P. Folgarait; P. Lavelle & J.P. Rossi. 2004. Soil macrofaunal communities along an abandoned rice field chronosequence in Northern Argentina. Applied Soil Ecology 27: 23-29.
91. Torales, GJ; JM Coronel; ER Laffont; JL Fontana & MC Godoy. 2009. Termite Associations (Insecta, Isoptera) in natural or semi-natural plant communities in Argentina. Sociobiology 54(2): 383-437.
92. Vasconcellos, A; AG Bandeira; FM Moura; VF Araújo, AB Gusmão & R Constantino. 2010. Termite assemblages in three habitats under different disturbance regimes in the semi-arid Caatinga of NE Brazil. J. Arid Environ. 74: 298-302.
93. Wolters, V. 2001. Biodiversity of soil animals and its function. Eur. J. Soil Biol. 37: 221-227.
94. Zhao, J; Y Shao; X Wang ; D Neher ; G Xu ; Z Li & S Fu. 2013. Sentinel soil invertebrate taxa as bioindicators for forest management practices. Ecol. Indic. 24: 236-239.