BIOLOGÍA DEL SUELO
Macrofauna edáfica asociada a diferentes ambientes de un vivero forestal
(Santa Fe, Argentina)
Carolina Elisabet Masin*1; María Soledad Cruz2; Alba Rut Rodríguez1-2; Mariano José Demonte2;
Leticia Antonia Vuizot2; María Inés Maitre1; José Luis Godoy1 & Melina Soledad Almada3
1 Instituto de Desarrollo Tecnológico para la Industria Química-CONICET
2 Facultad de Humanidades y Ciencias, Universidad Nacional del Litoral
3 EEA INTA- CONICET Reconquista, Santa Fe
* Autor de contacto: cemasin@santafe-conicet.gov.ar
Recibido: 14-05-16
Recibido con revisiones: 26-09-16
Aceptado: 02-10-16
RESUMEN
La edafofauna comprende una gran variedad de organismos que intervienen en numerosos procesos del suelo, afectando tanto
el crecimiento de la vegetación como el mantenimiento de la productividad. El objetivo del trabajo fue estudiar la abundancia
y composición de la macrofauna en relación a tres ambientes con uso del suelo, características edáficas y composición vegetal
diferentes, localizados en el vivero forestal de Recreo Sur (Santa Fe, Argentina). Se extrajeron de cada ambiente 15 bloques de suelo
en primavera 2013 y otoño 2014 siguiendo el método estándar TSBF. Se determinaron densidad, número de familias y grupos
funcionales por ambiente. Se colectaron un total de 5344 individuos pertenecientes a 17 órdenes y 56 familias. La densidad media
de la macrofauna mostró diferencias entre ambientes (P< 0,05), destacándose Parquizado con el valor más alto (966 ind.m-2). El
número de familias fue mayor en Pastizal (43) siguiendo Plantación (31) y Parquizado (29). Los taxa más representativos fueron
Hymenoptera (47,93%), Haplotaxida (26,83%), Isopoda (8,29%), Coleoptera (7,20%), Chilopoda (3,07%) y Araneae (2,35%). Los
grupos funcionales mostraron diferencias por ambiente (P< 0,05), siendo los más abundantes los ingenieros del suelo (745
ind.m-2) y los detritívoros (151 ind.m-2) en Parquizado y herbívoros en Pastizal (28 ind.m-2). El grupo depredadores no mostró diferencias
entre ambientes (P> 0,05). Nuestros resultados muestran que las comunidades de macrofauna variaron, no sólo en relación
al uso del suelo sino también por la composición vegetal presente en los ambientes del vivero forestal.
Palabras clave: Macroinvertebrados; Medio edáfico; Composición vegetal; Uso del suelo.
Edaphic macrofauna associated with different environments of a forest
nursery (Sant Fe, Argentina)
ABSTRACT
The soil fauna includes a variety of organisms involved in many soil processes, affecting the vegetation growth and the
productivity. The objective was to study the abundance and composition of the macrofauna in three different environments
with differences land uses, soil characteristics and vegetation composition, of a forest nursery located in Recreo Sur (Santa
Fe, Argentina). Fifteen blocks of soil were extracted from each environment in spring 2013 and autumn 2014 following the
TSBF standard method. Density, families number and functional groups per environment were determined. A total of 5344
organisms were collected, representing 17 orders and 56 families. Macrofauna’s average density showed differences between
environments (P < 0.05), especially Parquizado, with the highest value (966 ind.m-2). Family numbers were higher in Pastizal
(43) following Plantación (31) and Parquizado (29). The most representative taxa of all organisms collected were Hymenoptera
(47.93%), Haplotaxida (26.83%), Isopoda (8.29%), Coleoptera (7.20%), Chilopoda (3.07%) and Araneae (2.35%). Functional
groups showed differences (P <0.05), the most abundant were soil engineers (745 ind.m-2) and detritivorous (151 ind.m-2) in
Parquizado and herbivores in Pastizal (28 ind.m-2). Predators group showed no differences between environments (P > 0.05).
Our results show that macrofauna’s communities varied, not only in relation to land use but also by the plant composition
present in the forest nursery environments.
Key words: Macroinvertebrates; Soil; Vegetal composition; Land use.
INTRODUCCIÓN
La fauna edáfica es esencial en el mantenimiento de los
servicios ecosistémicos del suelo y está constituida por
organismos que pasan toda o una gran parte de su vida sobre
la superficie del mismo, en los troncos caídos parcialmente
degradados, en la hojarasca superficial y también en el interior del perfil (Lavelle, 1997; Brown et al., 2000). Comprende una gran variedad de organismos que colectivamente intervienen en numerosos procesos del suelo: regulan el
ciclo de nutrientes y flujo de carbono, modifican la estructura física y actúan sobre el régimen del agua y la erosión,
asegurando así el mantenimiento de suelos productivos
(Linden et al., 1994; Cole et al., 2006; Lavelle et al., 2006).
De acuerdo al tamaño del cuerpo, la fauna del suelo se
divide en tres grupos: la microfauna que comprende los
organismos que presentan un ancho de cuerpo menor a 0,1
mm, como los nemátodos y protozoarios; la mesofauna
constituida por los que miden entre 0,1 a 2 mm, incluyendo
microartrópodos como ácaros y colémbolos y, la macro-fauna integrada por animales con un ancho de cuerpo mayor
a 2 mm, visibles al ojo humano. Los organismos de este último grupo actúan como agentes determinantes en la
fertilidad del suelo y, por ende, en el funcionamiento global
del sistema edáfico (Lavelle et al., 2003).
La biota del suelo afecta la composición de las comunidades vegetales (Zerbino, 2011). Según Harvé & Vidal
(2008) y Ramírez Meneses (2009), las comunidades de invertebrados edáficos se ven favorecidas por ambientes caracterizados por diversidad florística, donde las plantas proporcionan el carbono y los recursos que los organismos utilizan en la descomposición interactuando con las raíces.
Los sistemas forestales se caracterizan por una complejidad biológica que mediante una gestión agronómica
forestal productiva promueve la recuperación y conservación del suelo (Gándara et al., 2007; Vásquez Vela, 2014).
Además, la distribución, composición y estructura de los
sistemas forestales, íntimamente ligadas a condiciones ambientales circundantes, condicionan el comportamiento de
las comunidades de organismos edáficos, quienes a su vez
inciden en las características del hábitat como también en
su dinámica y evolución (Castillo Sánchez, 2003).
Los organismos de la macrofauna, según la actividad
que desempeñan, pueden ser clasificados en grupos fun-
cionales como los ingenieros del suelo, detritívoros, herbívoros y depredadores; la actividad de los diferentes grupos regula los procesos edáficos del ecosistema (Cabrera et al., 2011a; Cabrera, 2012). Cuando el hábitat es intervenido, los cambios producidos por el uso del suelo afectan la
composición, abundancia y diversidad de la macrofauna
como así también a sus interacciones con la vegetación
(Velásquez et al., 2009; Zerbino, 2011; Cabrera et al.,
2011b; Vasconcellos et al., 2013).
Los viveros forestales son el punto de partida necesario para revertir la degradación de los recursos naturales
y mejorar la calidad de vida de la población. Es así que constituyen centros de apoyo para diferentes programas de reforestación, contrarrestando tanto la pérdida de áreas deforestadas como la falta de árboles y espacios verdes en las
ciudades (Navall, 2004; Laguna, 2010).
En la localidad de Recreo Sur, provincia de Santa Fe, se
encuentra el Centro Operativo Forestal (COF), predio de
15 ha dedicado a la producción y multiplicación de especies
forestales nativas y exóticas con fines de reforestación
urbana y rural en la provincia (Gobierno de Santa Fe, 2014).
El COF constituye un importante sistema de diversificación de especies, formado por numerosas unidades con
composición y estructura vegetal diferentes. Como parte
del funcionamiento de este ambiente interviene la edafofauna, la cual a su vez, es influenciada por las características del hábitat y del uso del suelo (Tapia et al., 2002; Salmona et al., 2006).
El objetivo de este trabajo fue estudiar la abundancia
y composición de la macrofauna en tres ambientes con uso
del suelo, características edáficas y vegetación diferentes
en el Centro Operativo Forestal de Recreo Sur de la provincia de Santa Fe.
MATERIALES Y MÉTODOS
Características del área de estudio
El estudio se realizó en el predio del COF (31°33’1,89"S;
60°43’46,78"O) de la localidad de Recreo Sur provincia de Santa
Fe, destinado a la producción de especies forestales y ornamentales (Fig. 1). La zona presenta temperatura mínima
promedio anual de 17 °C, máxima promedio anual de 20 °C
y régimen de precipitaciones que varía entre 900 y 1000 mm
anuales (UNL, 2016). Para el estudio se seleccionaron tres ambientes, con diferencias en composición vegetal y uso del suelo,
presentando cada uno una superficie de 100 m2 y distanciados
por 150 m.

Figura 1. Localización del COF (delimitado de forma rectangular) y los tres ambientes de estudio (delimitados por círculos): I= Parquizado, II= Plantación,
III= Pastizal, en Recreo Sur, Santa Fe (Argentina).
Figure 1. Location of COF (rectangle) and the three environments of study (circles): I = Parquizado, II = Plantación, III = Pastizal in Recreo Sur,
Santa Fe (Argentina).
- Ambiente I ‘‘Parquizado’’: área demostrativa con estrato herbáceo y arbóreo variado. Desde hace 30 años presenta
mínima intervención antrópica, con especie herbácea dominante, césped brasilero (Axonopus compressus (Sw.) P. Beauv.)
formando una ‘‘cubierta homogénea’’, acompañado de oreja
de ratón (Dichondra repens JR Forts & G Gorts); diente de león
(Sonchus sp L); pata de perdíz (Cynodon dactylon (L) Person);
lágrima de la Virgen (Nothoscordum gracile (Dryand. ex Aiton)
Stearn); flechita (Stipa sp L); entre otras. Entre las especies
arbóreas se hallan magnolia (Magnolia grandiflora L); palmeras (Washingtonia filifera (Linden ex André) H. Wendl), Syagrus
romanzoffiana (Cham.) Glassman, y Phoenix canariensis
Chabaud); roble (Querqus borealis F Michx); mora (Morus nigra L); laurel de jardín (Nerium oleander L); ciprés (Cupressus sempervirens L); tipa (Tipuana tipu (Benth) Kuntze); lapacho
rosado (Tabebuia impetiginosa Standl), ciprés calvo (Taxodium distichum (L) Rich); pezuña de vaca (Bauhinia variegata L); pino
(Pinus sp L); gingo (Ginkgo biloba L); araucaria (Araucana angustifolia (Bertol) Kuntze); lapacho amarillo (Tabebuiachrysotricha Standl), entre otras.
- Ambiente II ‘‘Plantación’’: sitio dedicado al cultivo de especies de salicáceas, en particular sauce (Salix humboldtiana Wild.) y álamo (Populus sp). Actualmente las especies arbóreas
tienen 12 años de edad. Complementa este ambiente un estrato herbáceo con especies cola de zorro (Pennisetum setaceumrubrum (Forssk) Chiov); maicillo (Sorghum halepense (L) Pers);
cardos (Cirsium vulgare (Savi) Ten y Dipsacus fullonum L); paja
brava (Cortaderia selloana (Schult & Schult F) (Asch. & Graebn); oreja de ratón (D. repens JR Forts & G Gorts); lengua de vaca
(Rumex crispus L); diente de león (Sonchus sp L); entre otras.
- Ambiente III ‘‘Pastizal’’: suelo con estrato herbáceo desde
hace un año, con predominio de: manzanilla (Matricaria
chamomilla L); biznaga (Ammi visnaga L Lam.); yuyo blanco
(Chenopodium álbum L Bosc Ex Moq); maicillo (S halepense (L)
Pers); lengua de vaca (R crispus L); diente de león (Sonchus sp
L); cardos (C vulgare (Savi) Ten y D fullonum L); tréboles (Oxalis sp L y Melilotus sp (L) Mill). Anteriormente (hace cinco años)
el sitio presentaba práctica semillera de fresno (Fraxinus americana L) con aplicación de herbicidas para control de malezas.
Características del muestreo
Los muestreos se realizaron durante la primavera de 2013
y el otoño de 2014 extrayéndose en cada sitio 15 bloques de
suelo de 0,30 x 0,30 x 0,30 m siguiendo el método estándar
internacional Biología y Fertilidad del Suelo Tropical o TSBF
(Anderson & Ingram, 1993). En laboratorio se realizó la revisión de los bloques y colecta manual de los organismos, los
cuales fueron conservados en alcohol al 70%. Los individuos
se identificaron hasta el nivel de familia siguiendo claves de
Righi (1979), Mischis (1991), Peña Guzmán (1996), Morrone & Coscarón (1998), Ramírez (1999) y Momo & Falco (2009).
Desde el punto de vista funcional la macrofauna fue agrupada
en cuatro gremios fundamentales: ingenieros del suelo, detritívoros, herbívoros y depredadores, de acuerdo con Lavelle (1997)
y Zerbino et al. (2008).
En cada uno de los ambientes y siguiendo un diseño al azar
en forma de zigzag, se tomaron tres muestras de suelo a 15 cm
de profundidad para la determinación de las propiedades físicas y químicas: contenido de materia orgánica (MO) (%) y carbono orgánico (C) (%) por el método de Walkley & Black (Walkley & Black, 1934); nitrógeno total (N) (%) por Kjeldahl macroescala (MAG, 1982); pH por el método potenciométrico en relación suelo-agua 1:2,5 p/v (Jackson, 1976); Densidad Aparente (DA) (g/cm3) por el método del cilindro (Baver et al., 1973);
Capacidad de Intercambio Catiónico (CIC) (me/100 g) con uso
de Acetato amonio 1 N pH 7 para la extracción de cationes
intercambiables (MAG, 1982) y textura por método de pipeteado para análisis granulométrico de fracciones menores a 62
micrones (Gee & Bauder, 1986).
La determinación de estas características físicas y químicas
se realizó en el laboratorio del IDICYT de Universidad Católica
de Santa Fe.
Análisis de datos
Se determinaron densidad (individuo.m-2) media total y
número de familias total por ambiente.
Para determinar diferencias de significación estadística
entre la densidad total de la macrofauna y de los taxa por
ambiente, se utilizó el análisis de varianza no paramétrico para
muestras independientes (Kruskal-Wallis). De igual manera se
analizaron los grupos funcionales.
Para determinar la relación entre las variables físicas y
químicas y abundancia de la macrofauna de los diferentes ambientes se realizó un análisis de componentes principales (ACP).
En este análisis se asume como variables predictoras a las propiedades pH, C, N, DA, MO, Ca2+, Mg2+, Na+ (Tabla 1) y como
variables respuesta a las abundancias transformadas (Godoy et
al., 2014) de los grupos Haplotaxida, Hymenoptera, Isopoda,
Coleoptera, Chilopoda y Araneae. El ACP se efectuó sobre la
matriz de datos, compuesta por 30 observaciones (15 en otoño
y 15 en primavera) en cada uno de los tres tipos de ambientes.
Cada observación posee seis abundancias transformadas que
describen la composición de la comunidad y ocho propiedades
físicas y químicas que describen el suelo ambiente. Las abundancias fueron transformadas utilizando la transformación de
Hellinger (Legendre & Gallagher, 2001). La matriz de datos Z = [Y X] (90×14), donde cada renglón de la matriz X (90×8),
presentó la observación de las ocho variables físico-químicas y
donde cada renglón de la matriz Y (90×6) correspondió a una
observación de las seis abundancias transformadas.
Tabla 1. Propiedades físicas y químicas del suelo de los ambientes Parquizado, Plantación y Pastizal en
el Centro Operativo Forestal, de Recreo Sur, Santa Fe (Argentina).
Table 1. Physical and chemical properties of soil of the environments Parquizado, Plantación and Pastizal
from the Centro Operativo Forestal, Recreo Sur, Santa Fe (Argentina).

Referencia: DE= Desvío estándar (n= 6).
Cada medición de las propiedades edáficas se realizó sobre
un compuesto de tres bloques consecutivos, por tanto se dispuso de una medición de las propiedades edáficas cada tres
mediciones de densidades tomadas en otoño y primavera; es
decir, una medición de propiedades cada seis mediciones de
densidades. En consecuencia, se replicaron las muestras en la
matriz X para que ésta posea el mismo número de observaciones que la matriz Y.
Los análisis estadísticos se realizaron utilizando el software
InfoStat ver. 2008 (Di Rienzo et al., 2008).
RESULTADOS
Abundancia y composición de la macrofauna
Se colectaron en los tres ambientes un total de 5344
individuos representando a 17 órdenes y 56 familias (Tabla 2).
Tabla 2. Abundancia total de los organismos de la macrofauna colectados en los ambientes Parquizado, Plantación y Pastizal del COF de Recreo Sur (Santa
Fe, Argentina).
Table 2. Total macrofauna abundance collected from Parquizado, Plantation and Pastizal environments of COF, Recreo Sur (Santa Fe, Argentina).

La densidad media de la macrofauna mostró diferencias significativas entre los ambientes (H= 8,13; P< 0,05),
destacándose Parquizado con el valor más alto (966 ind.
m-2) respecto a Pastizal (533 ind.m-2) y Plantación (480 ind.
m-2). El número de familias fue mayor en Pastizal (43) siguiendo Plantación (31) y por último Parquizado (29) (Fig. 2). Los
grupos que mostraron porcentajes representativos respecto al total de los organismos recolectados fueron Hymenoptera (47,93%), Haplotaxida (26,83%), Isopoda
(8,29%), Coleoptera (7,20%), Chilopoda (3,07%) y Araneae
(2,35%). En Hymenoptera se destacó la familia Formicidae
(54,43%), en Haplotaxida Megascolecidae (89,33%); en
Isopoda el 100% de los individuos pertenecieron a Oniscidae,
en Coleoptera la familia Staphylinidae (63,89%), en Chilopoda la familia Henicopidae (2,88%) y por último en Araneae
la familia Linyphiidae (29,36%). Si bien estos grupos estuvieron presentes en los tres ambientes, Plantación registró valores bajos en la mayoría de ellos.

Figura 2. Densidad media total y número de
familias de la macrofauna edáfica en
los tres ambientes estudiados. Las
barras verticales indican el error
estándar. Letras distintas indican
diferencias significativas (P< 0,05)
en densidad entre ambientes.
Figure 2. Total average density and families
number of soil macrofauna in the
three environments studied. Vertical
bars show standard error. Different
letters show significant density
differences (P <0.05) between
environments.
Respecto a la abundancia de los grupos, hubo diferencias significativas en los ambientes (P< 0,05). Hymenoptera, Haplotaxida y Chilopoda mostraron mayor densidad
en Parquizado, registrando 509 ind.m-2 (H=4,79; P<0,05),
236 ind.m-2 (H= 11,68; P< 0,05) y 34 ind.m-2 (H=5,39; P<0,05), respectivamente. Coleoptera presentó mayor número de individuos tanto en Pastizal como en Plantación
(86 y 85 ind.m-2, respectivamente), diferenciándose significativamente de Parquizado (H= 26,81; P< 0,05). En
tanto los grupos Isopoda y Araneae no presentaron diferencias entre los ambientes (P>0,05) (Fig. 3).
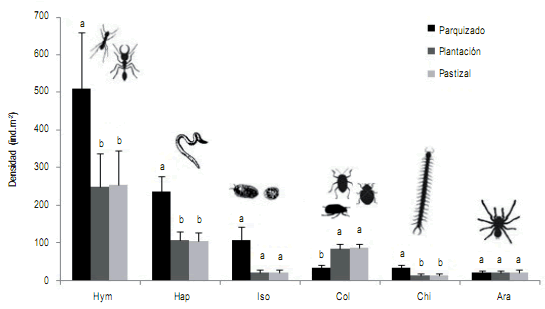
Figura 3. Densidad media de los grupos de macrofauna más abundantes en los tres ambientes. Las barras verticales indican error estándar. Letras
distintas indican diferencias significativas (P< 0,05) entre ambientes para el mismo grupo taxonómico.
Referencias: Hap: Haplotaxida; Hym: Hymenoptera; Iso: Isopoda; Col: Coleoptera; Chi: Chilopoda; Ara: Araneae.
Figure 3. Average density of the most abundant macrofauna groups in the three environments. Vertical bars show standard error. Different letters
show significant differences (P <0.05) between environments for the same taxonomic group.
References: Hap: Haplotaxida; Hym: Hymenoptera; Iso: Isopoda; Col: Coleoptera; Chi: Chilopoda; Ara: Araneae.
Distribución de grupos funcionales en los diferentes
ambientes
La macrofauna fue asociada a los grupos funcionales
ingenieros del suelo, detritívoros, herbívoros y depredadores, los cuales estuvieron presentes en los tres ambientes (Fig. 4). Dentro de los ingenieros del suelo se incluyeron organismos consumidores de materia orgánica como
las lombrices de tierra (Haplotaxida) y los omnívoros como
las hormigas (Hymenoptera: Formicidae). Entre los detritívoros se hallaron organismos pertenecientes a los grupos Diplopoda, Coleoptera (algunas familias como Tenebrionidae, Silphidae, Scaphidiidae, entre otras), Diptera,
Orthoptera e Isopoda. En el caso de los herbívoros, cuyos
hábitos alimenticios responden a la herbivoría de raíces o
foliar (como la que se puede encontrar en el suelo) se observaron a representantes del grupo Coleoptera (las familias Elateridae, Bostrichidae, Scarabaeidae, entre otras),
Hemiptera (como Aradidae, Miridae, Reduviidae, entre
otras) y Orthoptera (Gryllidae, Gryllacrididae, entre otras).
Para depredadores, los grupos involucrados fueron
Araneae, Chipoloda, Opiliones, Pseudoescorpionida,
Coleoptera (como Staphylinidae, Carabidae), Dermaptera,
Diplura, Diptera e Hymenoptera (Vespidae).

Figura 4. Densidad media de los grupos funcionales de la macrofauna edáfica en cada ambiente. Las barras verticales indican el error estándar. Letras
distintas indican diferencias significativas (P< 0,05) entre ambientes para el mismo grupo funcional.
Referencias: IdS: Ingenieros del suelo; Det: Detritívoros; Her: Herbívoros; Dep: Depredadores.
Figure 4. Average density of macrofauna’s functional groups of soil in each environment. Vertical bars show standard error. Different letters show
significant differences (P <0.05) between environments for the same functional group.
References: IdS: Engineers soil; Det: Detritivorous; Her: Herbivores; Dep: Predators.
La densidad de los grupos funcionales varió entre los ambientes (P< 0,05), donde en Parquizado, los grupos más abundantes fueron los ingenieros del suelo con 745 ind.m-2 (H=
9,92; P< 0,05) y los detritívoros con 151 ind.m-2 (H= 7,88; P< 0,05).
La densidad de los herbívoros fue mayor en el ambiente Pastizal registrando 28 ind.m-2 (H= 11,29; P< 0,05),
mientras que el grupo depredadores no mostró diferencias
entre los ambientes analizados (P> 0,05).
Relación biota edáfica y variables físicas y químicas
La Figura 5 muestra las relaciones existentes entre las
propiedades edáficas y la abundancia de los diferentes grupos de la macrofauna. Los dos primeros componentes principales (CP 1= 35,4% y CP 2= 19%) explicaron más del 50%
de la variabilidad total. El biplot permite visualizar la magnitud y signo de la contribución de cada variable a estos dos
componentes principales, y como cada observación es
representada en términos de estos componentes.

Figura 5. Biplot del análisis de componentes principales (ACP) para las variables físicas y químicas (variables predictoras), y los grupos de organismos
en los tres ambientes (I= Parquizado, II= Plantación, III= Pastizal) del COF, Santa Fe. Referencias de variables respuestas: Hap=Haplotaxida,
Hym=Hymenoptera, Iso=Isopoda, Col=Coleoptera, Chi=Chilopoda, Ara=Araneae.
Figure 5. Principal component analysis (PCA) biplot for the physical and chemical variables (predictor variables) and organism groups from the three
environments (I= Parquizado, II= Plantación, III= Pastizal) of COF, Santa Fe. References of variable responses: Hap=Haplotaxida, Hym=
Hymenoptera, Iso=Isopoda, Col=Coleoptera, Chi=Chilopoda, Ara=Araneae.
Hacia la derecha se ubicó el ambiente menos perturbado (Parquizado), relacionado con valores altos en residuos de materia orgánica (MO), carbono (C), nitrógeno (N),
calcio (Ca2+) y magnesio (Mg2+). Los grupos de la macrofauna que mostraron estar más asociados a este sistema
fueron Hymenoptera, Chilopoda, Isopoda y Haplotaxida.
Por el contrario, a la izquierda se ubicaron Plantación y
Pastizal, ambientes caracterizados por una fertilidad menor y por la presencia en mayor densidad de los grupos
Coleoptera y Araneae.
DISCUSIÓN
El Centro Operativo Forestal visto como un mosaico
heterogéneo de especies vegetales, brinda diferentes hábitats como alternativas de refugio y oferta alimenticia para
la fauna edáfica. Según Mudrák et al. (2010) y Jangida et al. (2011), la vegetación que forma parte del ecosistema
forestal influye no sólo en numerosas propiedades del
suelo, sino también en su edafofauna, la cual establece una
fuerte retroalimentación sobre el componente vegetal
existente. No obstante, la abundancia y composición de
las comunidades de la fauna del suelo también son afectadas por el uso y manejo que se haga del mismo (Rodríguez et al., 2002; Mathieu et al., 2009; Zerbino, 2011; Neto et
al., 2012; Korboulewsky et al., 2016).
Los resultados muestran que la abundancia y composición de la macrofauna varió en los diferentes ambientes,
siendo Parquizado el que registró las mayores densidades
de los grupos edáficos. Posiblemente esto se deba a que
este ambiente, en especial el suelo, presentaba retención
de humedad y no estuvo expuesto a actividades mecánicas (como remoción del suelo), y/o de aplicación de productos (agroquímicos) como sí lo estuvieron los otros ambientes. Según Xiunqin & Tingcheng (2001), el efecto de
factores como el tipo de vegetación, características edáficas, manejo del suelo y condiciones microclimáticas influyen en el comportamiento de la edafofauna.
Trabajos de Martínez (2002), Prieto et al. (2003), Feijoo et al. (2007), Siqueira et al. (2014) y Tsiafouli et al. (2015),
evidenciaron que las abundancias de los grupos taxonómicos Hymenoptera, en particular Formicidae, y Haplotaxida son sustancialmente mayores en los ambientes con
menor intervención antrópica, respondiendo sensiblemente al manejo del suelo. Estos resultados coinciden con
los hallados en el presente estudio donde, del total de los
organismos colectados, Parquizado presentó entre 45-55% para Haplotaxida y Formicidae, mientras que los ambientes Plantación y Pastizal solo registraron entre 30-20%. Para el estudio de organismos sociales como las hormigas, algunos trabajos (Ekschmutt et al., 2003; Leponce et al., 2004; Vasconcellos et al., 2010) consideran adecuado el número de colonias o de especies como indicador de abundancia, pero en este trabajo al igual que en el
de Rossi et al. (2006), Rousseau et al. (2013) y Gómez
Pamies et al. (2016), se consideró el número de individuos,
pues ello posibilita el análisis conjunto con el resto de los
grupos de la macrofauna.
Tanto las lombrices de tierra como las hormigas son
sensibles a variaciones en su medio edáfico, sobre todo por
disturbios antrópicos, por lo que manifiestan cambios en
composición y abundancia en una corta escala de tiempo
(Vasconcelos, 2008; Chocobar, 2010). Específicamente
trabajos de Rodríguez (2000), Cabrera (2012) y Gómez
Pamies et al. (2016), relacionan que la perturbación de los
hábitats naturales y, como consecuencia cambios en el
contenido de materia orgánica del suelo y pérdida o transformación de la vegetación original, determinan disminución de la abundancia y riqueza de lombrices de tierra.
Morán Mendoza & Alfaro Gutiérrez (2015), destacaron a los ingenieros del suelo como los más abundantes en bosques y sistemas agroforestales, en especial en ambientes con mayor cobertura vegetal, riqueza de exudados
y sombra, condiciones que benefician a dichos organismos,
en especial a las lombrices de tierra. Este grupo funcional
tiene un impacto específico en el interior del suelo a partir
de la transformación de las propiedades físicas, que favorecen agregados y la estructura, el movimiento y la retención del agua, así como el intercambio gaseoso (Lavelle,
2000; Cunha et al., 2016).
Los artrópodos con función detritívora fueron más
abundantes en Parquizado, y según aportes de Rodríguez et al. (2002), Zerbino et al. (2008) y Cabrera et al. (2011a),
este grupo funcional es más abundante y diverso en ambientes con una incorporación continua y variada de hojarasca, temperatura y humedad óptima en el suelo. En conjunto, estos organismos ayudan a fragmentar la hojarasca
del suelo e inician el proceso de descomposición, aumentando así la superficie de exposición para el ataque de la
microflora (Cabrera, 2012). Posiblemente la menor abundancia de detritívoros tanto en Pastizal como en Plantación se deba a transformaciones en las condiciones ambientales de sus suelos debidas a actividades de laboreo
asociadas a la plantación o extracción de especies de árboles. Según Barraqueta (2001), Mathieu et al. (2005) y
Marichal et al. (2014), estas prácticas de manejo en ecosistemas forestales (tala de árboles e implantación de otra/s especie/s vegetales) afectan la diversidad y densidad tanto de los principales grupos de descomponedores de la materia orgánica como de otras comunidades de la macrofauna del suelo, ya que provocan variaciones bruscas en condiciones de temperatura y humedad del suelo, cobertura
y calidad de la hojarasca, cantidad de residuos, y destrucción mecánica de los microhábitats.
El grupo de los Herbívoros, en gran parte coleópteros,
se concentraron mayormente en Pastizal. Según Laossi et
al. (2008), los herbívoros se ven favorecidos por ambientes herbáceos, con influencia total de gramíneas, donde hay
buena cantidad de fitomasa aérea y subterránea.
Respecto a los depredadores se manifestaron de manera similar entre los ambientes analizados, posiblemente
se deba tanto a factores de temperatura y humedad del suelo
como a la cantidad de detritívoros que sirvieron de alimento a dicho grupo funcional (Pontégnie et al., 2005; Baloriani et al., 2009; Cabrera et al., 2011a). No obstante, los
ambientes con vegetación espontánea, como Pastizal,
pueden ser muy importantes como fuente de refugio, proveyendo sitios de hibernación y fuentes de alimentos alternativos para los depredadores del suelo y su presencia
contribuiría a mantener controladas las poblaciones de
fitófagos (Lang, 2003; Saavedra et al., 2007; Paleologos et al., 2008; Marasas et al., 2010).
Las arañas como parte del grupo funcional depredadores fue el taxón más representativo en abundancia. Estos
arácnidos son un componente importante de los ecosistemas regulando la actividad de otros organismos más
pequeños (Cardoso et al., 2011; Díaz Porres et al., 2014).
La familia Linyphiidae mostró la mayor abundancia dentro del grupo, lo cual se relaciona directamente con la composición y complejidad del paisaje (Schmidt et al., 2005),
debido a que esta familia es una de las que mejor se adapta
y resiste a los sistemas con disturbio (Samu & Szinetár,
2002; Schmidt & Tscharntke, 2005).
Si bien, el Centro Operativo Forestal de Recreo Sur
cuenta con una extensa superficie y variedad de especies
forestales y ornamentales, por cuestión de planificación
del lugar se han generado ambientes mixtos de especies
vegetales (como lo representa Parquizado), y otros dedicados a producir una sola especie de planta (como el caso
de Plantación). Según Farska et al. (2014), la composición
de vegetales y heterogeneidad de ambientes que presenten los ecosistemas forestales, dependientes de sus prácticas de gestión, influyen en la diversidad y funcionamiento de la fauna del suelo. Otros autores (Jactel & Brockerhoff,
2007; Pretzsch et al., 2010; Vallet & Perot, 2011; Merlin et al., 2015), destacan que ambientes mixtos, diversos en
especies vegetales son susceptibles a albergar mayor diversidad biológica en organismos edáficos, y que a su vez
presentan mejor resistencia a ciertas alteraciones bióticas.
CONCLUSIONES
Los resultados muestran que los ambientes Parquizado
y Pastizal registraron los mayores valores en densidad y
riqueza de familias de la macrofauna edáfica, respectivamente. De manera que las comunidades de la edafofauna variaron, no sólo en relación a propiedades edáficas y manejo del
suelo sino también por la composición vegetal presente en
los ambientes del vivero forestal, afectando asimismo las
interacciones entre los grupos funcionales.
El presente trabajo contribuye a enriquecer el inventario de los macroinvertebrados del vivero forestal (COF)
de Recreo Sur, Santa Fe, constituyendo una información
básica, útil y complementaria en estrategias de manejo y
sustentabilidad de los ambientes del vivero forestal.
Se propone continuar con nuevas líneas de estudio profundizando la importancia de la dinámica de los grupos de
la edafofauna en el desarrollo y funcionamiento de la vegetación forestal, en especial de las autóctonas.
AGRADECIMIENTOS
Los autores agradecen a la Ing. Agr. María Virginia
Quiñonez, Jefa de Departamento Regímenes Promocionales Forestales, del Centro Operativo Forestal Santa Fe
(Ministerio de la Producción de Santa Fe), por facilitar la
realización de los muestreos y brindar información relevante para el desarrollo del trabajo de investigación.
BIBLIOGRAFÍA
1. Anderson, JM & JSI Ingram. 1993. Tropical Soil Biology and Fertility:
A Handbook of Methods. 2nd ed. CAB International. Wallingford,
UK. 221 pp.
2. Baloriani, G; MF Paleologos; ME Marasas & SJ Sarandón. 2009. Abundancia y riqueza de la macrofauna edpafica (Coleóptera y Araneae),
en invernáculos convencionales y en transición agroecológica. Rev.
Bras. de Agroecología 4(2): 1733-1737.
3. Barrequeta, P. 2001. La fauna del suelo: entre la repoblación forestal
y la tala. En: Conservación, uso y gestión de los sistemas forestales.
VI Jornada de Urdaibai sobre desarrollo sostenible (Coord. MD Salinas,
MC de la Huerga & C Giménez). Departamento de ordenación del
territorio, vivienda y medio ambiente, Gobierno Vasco, España.
257 pp.
4. Baver, LD; WH Gardner & WR Gardner. 1973. Física de suelos. Ed.
UTEHA. México. 529 pp.
5. Brown, GG; I Barois & P Lavelle. 2000. Regulation of soil organic matter
dynamics and microbial activity in the drilosphere and the role
of interactions with other edaphic functional domains. Eur. J. Soil
Biol 36(3-4): 177-198.
6. Cabrera, G; N Robaina & D. Ponce de León. 2011a. Composición
funcional de la macrofauna edáfica en cuatro usos de la tierra en
las provincias de Artemisa y Mayabeque, Cuba. Pastos y Forrajes
34: 331-346.
7. Cabrera, G; N Robaina & D Ponce de León. 2011b. Riqueza y abundancia de la macrofauna edáfica en cuatro usos de la tierra en las
provincias de Artemisa y Mayabeque, Cuba. Pastos y Forrajes 34:
313-330.
8. Cabrera, G. 2012. La macrofauna edáfica como indicador biológico
del estado de conservación/perturbación del suelo. Resultados
obtenidos en Cuba. Pastos y Forrajes 35(4): 349-364.
9. Cardoso, P; S Pekár; R Jocqué & JA Coddington. 2011. Global patterns
of guild composition and functional diversity of spiders. PLoS ONE
6(6): 1-10.
10. Castillo Sánchez, VM. 2003. Funciones protectoras de los sistemas
forestales. En: MA Esteve Selma; M Lloréns Pascual de Riquelmes & C Martínez Gallur (eds). Los recursos naturales de la región de
Murcia. Un análisis interdisciplinar. 1era ed. p 238-243. Servicio de
Publicaciones de la Universidad de Murcia. España. 447pp.
11. Chocobar, EA. 2010. Edafofauna como indicador de la calidad en un
suelo Cumulic Phaozem sometido a diferentes sistemas de manejo en un experimento de larga duración. Tesis presentada en opción al título académico de Máster en Ciencias, Colegio de Post-graduados. Montecillo, México. 63 pp.
12. Cole, L; MA Bradford; JA Shawp & RD Bradgett. 2006. The abundance,
richness and functional role of soil meso and macrofauna in
temperate grassland-A case study. Appl. Soil Ecol. 33: 186-198.
13. Cunha, L.; GG Brown; DW Stanton; E Da Silva; FA Hansel; G Jorge;
D McKey; P Vidal-Torrado; RS Macedo; E Velásquez; SW James;
P Lavelle & P Kille. The Terra Preta de Indio Network. 2016. Soil
animals and pedogenesis: the role of earthworms in anthropogenic
soils. Soil Science, Vol 181(3/4): 110-125.
14. Díaz Porres, M; MH Rionda; AE Duhour & FR Momo. 2014. Artrópodos del suelo: Relaciones entre la composición faunística y la intensificación agropecuaria. Ecología Austral 24: 327-334.
15. Di Rienzo, JA; F Casanoves; MG Balzarini; L González; M Tablada & CW Robledo. 2008. InfoStat, versión 2008. Grupo InfoStat, FCA,
Universidad Nacional de Córdoba, Argentina.
16. Ekschmitt, K; T Stierhoff; J Dauber; K Kreimes & V Wolters. 2003.
On the quality of soil biodiversity indicators: abiotic and biotic
parameters as predictors of soil faunal richnees at different spatial
scales. Agr. Ecosyst. Environ. 98: 273-283.
17. Farska, J; K Prejzkova & J Rusek. 2014. Management intensity affects
traits of soil microarthropod community in montane spruce forest. Appl. Soil Ecol. 75: 71-79.
18. Feijoo, A; M Zuñiga; H Quintero & P Lavelle. 2007. Relaciones entre
el uso de la tierra y las comunidades de lombrices en la cuenca del
río La Vieja, Colombia. Pastos y Forrajes, 30: 235-249.
19. Gándara, F; C Melo; M Grimaldi; G Oliveira; C Santilli & L Marchiori.
2007. Análise comparativa da macrofauna do solo de um sistema
agroflorestal e um agrícola convencional em Piracicaba SP. Rev.
Bras. de Agroecología 2(2): 1263-1267.
20. Gee, GW & JW Bauder. 1986. Particle-size analysis. In: Klute, A. (ed),
Methods of Soil Analysis. Part 1. Physical and Mineralogical Methods.
Agronomy Monograph N° 9, second ed. ASA and SSSA, Madison,
WI, 383-411.
21. Gobierno de Santa Fe. 2014. Presentación del Centro Operativo Forestal Santa Fe. https://www.santafe.gob.ar/index.php/web/con
tent/download/200991/974329/file/Presentaci%C3%B3n%20COF% 20SANTA% 20FE%202014%20(1).pdf (se accedió el 03/02/2016).
22. Godoy, JL & JR Vega & JL Marchetti. 2014. Relationships between
PCA and PLS-regression. Chem. Intell. Lab. Syst. 130: 182-191.
23. Gómez Paimes, DF; MC Godoy & JM Coronel. 2016. Macrofauna
edáfica en ecosistemas naturals y agroecosistemas de la eco-región
Esteros del Iberá (Corrientes, Argentina). Cienc. Suelo (Argentina) 34(1): 43-56.
24. Herve, BD & BS Vidal. 2008. Plant biodiversity and vegetation structure
in traditional cocoa forest gardens in southern Cameroon under
different management. Biodivers. Conserv. 17(8): 1821-1835.
25. Jackson, ML. 1976. Determinación de los cationes metálicos canjeables de los suelos. (p.:123-189). En: Análisis químico de suelos.
Ed. Omega S. A., Barcelona, España, 662 pp.
26. Jactel, H & EG Brockerhoff. 2007. Tree diversity reduces herbivory
by forest insects. Ecol. Let. 10: 835-848.
27. Jangida, K; MA Williams; AF Franzluebbers; TM Schmidt; DC Coleman & WB Whitman. 2011. Land-use history has a stronger impact
on soil microbial community composition than aboveground
vegetation and soil properties. Soil Biol. Biochem. 43: 2184-2193.
28. Korboulewsky, N; G Perez & M Chauvat. 2016. How tree diversity
affects soil fauna diversity: A review. Soil Biol. Biochem. 94: 94-106.
29. Laguna, RR. 2010. Manual de Prácticas de viveros forestales. 1ra Ed.
Universidad Autónoma del Estado de Hidalgo. Pachuca Hgo, México. 52 pp.
30. Lang, A. 2003. Intraguild interference and biocontrol effects of generalist
predators in a winter wheat field. Oecologia 134: 144-153.
31. Laossi, KR; S Barot; D. Carvalho; T Desjardins; P Lavelle; M Mastins;
D Mitja; AC Rendeiro; G Rousseau; M Sarrazini; E Velázquez & M
Grimaldi. 2008. Effects of plant diversity on plant biomass production and soil macrofauna in Amazonian pastures. Pedobiol. 51:
397-407.
32. Lavelle, P. 1997. Faunal activities and soil processes: adaptative
strategies that determine ecosystem function. Adv. Ecol. Res. 27:
93-102.
33. Lavelle, P. 2000. Ecological challenges for soil science. Soil Science
165: 73-86.
34. Lavelle, P; B Senapati & E Barros. 2003. Soil macrofauna. In: Schroth,
G & Sinclair, FL (eds). Trees, crops and soil fertility. Concepts and
research methods. CABI Publishing. UK. p 303-324.
35. Lavelle P; T Decaëns; M Aubert; S Barot; M Blouin; F Bureau; F Margerie;
P Mora & JP Rossi. 2006. Soil invertebrates and ecosystem services. Eur. J. Soil Biol. 42: 3-15.
36. Legendre, P & ED Gallagher. 2001. Ecologically meaningful transformations for ordination of species data. Oecologia 129(2): 271-280.
37. Leponce, M; L Theunis; J Delabie & Y Roisin. 2004. Sacle dependence
of diversity measures in a leaf-litter ant assemblage. Ecography 27:
253-267.
38. Linden, DR; PF Hendrix; DC Coleman & PCJ Van Vilet. 1994. Faunal
indicators of soil quality. In: Doran, JW & AJ Jones (eds). Defining
sol quality for a sustainable Environmental. SSSA. Special Publication
N° 35. 91-106.
39. Marasas, M; S Sarandón & A Cicchino. 2010. Semi-natural hábitats
and field margins in a typical agroecosystem of the Argentinean
pampas as a reservoir of carabid beetles. J. Sustain. Agr. 34: 1-16.
40. Marichal, R; M Grimaldi; MA Feijoo; J Oszwald; C Praxedes; DH Ruíz
Cobo; M Hurtado; T Desjardins; M Lopes da Silva Junior; L Gonzaga
da Silva Costa; I Souza Miranda; MN Delgado Oliveira; GG Brown;
S Tsélouiko; MB Martins; T Decaëns; E Velásquez & P Lavelle. 2014.
Soil macroinvertebrate communities and ecosystem services in
landscapes of Amazonia deforested. Appl. Soil Ecol. 83: 177-185.
41. Martínez, MA. 2002. Comunidades de oligoquetos (Annelida:
Oligochaeta) en tres ecosistemas con diferente grado de perturbación en Cuba. Tesis presentada en opción al grado científico de Doctor
en Ciencias Biológicas. Instituto de Ecología y Sistemática/Ministerio de Ciencia, Tecnología y Medio Ambiente. Ciudad de La Habana.
93 pp.
42. Mathieu, J; JP Rossi; P Mora; P Lavelle; PFDS Martins; C Rouland & M
Grimaldi. 2005. Recovery of soil macrofauna communities after
forest clearance in Eastern Amazonia, Brazil. Conserv. Biol. 19: 1598-1605.
43. Mathieu, J; M Grimaldi; P Jouquet; C Rouland; P Lavelle; T Desjardins;
JP Rossi. 2009. Spatial patterns of grasses influence soil macrofauna
biodiversity in Amazonian pastures. Soil Biol. Biochem. 41: 586-593.
44. Merlin, M; T Perot; S Perret; N Korboulewsky & P Vallet. 2015. Effects
of stand composition and tree size on resistance and resilience to
drought in sessile oak and Scots pine. Forest Ecol. Manag. 339: 22-33.
45. Ministerio de Agricultura y Ganadería (MAG). 1982. Toma de muestras
y determinaciones analíticas en suelos y aguas. Dirección General
de Extensión e Investigación Agropecuaria. Departamento de Apoyo
Analítico. Provincia Santa Fe. Argentina.
46. Mischis, CC. 1991. Las lombrices de tierra (Annelida, Oligochaeta)
de la Provincia de Córdoba, Argentina. Bol. Academia Nacional de
Ciencias Córdoba. 59(3 y 4): 187-237.
47. Momo, FR & LB Falco. 2009. Biología y Ecología de la fauna del suelo.
Ed. Imago Mundi. 1ª ed. Buenos Aires, Argentina. 208 pp.
48. Morán Mendoza, FE & FR Alfaro Gutiérrez. 2015. Diversidad de macrofauna edáfica en dos sistemas de manejo de Moringa oleifera Lam.
(Marango) en la finca Santa Rosa, UNA. Tesis presentada en opción
al grado de Ingeniero Forestal. Facultad de Recursos Naturales y del
Ambiente, Universidad Nacional Agraria. Managua, Nicaragua. 46
pp.
49. Morrone, JJ & S Coscarón. 1998. Biodiversidad de artrópodos argentinos: una perspectiva biotaxonómica. Sur. La Plata, Argentina. 599
pp.
50. Mudrák, O; J Frouz & V Velichová. 2010. Understory vegetation in
reclaimed and unreclaimed post-mining forest stands. Ecol. Eng.
36(6): 783-790.
51. Navall, M. 2004. El vivero forestal. Guía para el diseño y producción
de un vivero forestal de pequeña escala de plantas en envase. Proyecto
Forestal Regional INTA-EEA. Santiago del Estero.14 pp.
52. Neto, FVDC; MEF Correia; GHA Pereira; MG Pereira & PSDS Leles. 2012.
Soil fauna as an indicator of soil quality in forest stands, pasture
and secondary forest. Rev. Bras. Cienc. Solo 36( 5): 1407-1417.
53. Paleologos, MF; CC Flores; SJ Sarandón; SA Stupino & MM Bonicatto.
2008. Abundancia y diversidad de la entomofauna asociada a
ambientes seminaturales en fincas hosrtícolas de La Plata, Buenos
Aires, Argentina. Rev. Bras. Agroecología 3(1): 28-40.
54. Peña Guzmán, LE. 1996. Introducción al estudio de los insectos de
Chile. 4ta. Ed. Universitaria S.A. Santiago de Chile. 261pp.
55. Pontégnie, M; G du Bus de Warnaffe & P Lebrun. 2005. Impacts of
silvicultural practices on the structure of hemi-edaphic macrofauna
community. Pedobiol. 45: 199-210.
56. Pretzsch, H; J Block; J Dieler; PH Dong; U Kohnle; J Nagel; H Spellmann & A Zingg. 2010. Comparison between the productivity of pure
and mixed stands of Norway spruce and Euopean beech along an
ecological gradient. Ann. For. Sci. 67: 712-724.
57. Prieto, D; M Reinés; M Díaz; V González; T Tcherva & C Rodríguez. 2003.
Caracterización de la biodiversidad de la fauna edáfica cubana. Informe
final de proyecto. Programa ramal «Sistemática y colecciones biológicas». Facultad de Biología, universidad de La Habana.
58. Ramírez, MJ. 1999. Orden Araneae. En: Crespo, FA; Iglesias, MS & Valverde, AC (eds). El ABC en la determinación de artrópodos. Claves
para especímenes presentes en la Argentina I. Editorial CCC Educando, Buenos Aires. 107 pp.
59. Ramírez Maneses, A. 2009. Diversidad florística y macrofauna edáfica
en plantaciones agroforestales de cacao en Cárdenas, Tabasco. Tesis
presentada en opción al grado de Maestría en Ciencias. Instituto
de Enseñanza e Investigación en ciencias Agrícolas, H. Cárdenas Tabasco, México. 99 pp.
60. Righi, G. 1979. Introducción al estudio de las lombrices del suelo
(Oligoquetos Megadrilos) de la provincia de Santa Fe (Argentina). Rev. Asoc. Cienc. Nat. Litoral, 10: 89-155.
61. Rodríguez, C. 2000. Comunidades de lombrices de tierra (Annelida,
Oligochaeta) en ecosistemas con diferente grado de perturbación. Rev. Biol. 14: 147-155.
62. Rodríguez, I; V Torres; G Crespo & S Fraga. 2002. Biomasa y diversidad
de la macrofauna del suelo en diferentes pastizales. Rev. Cub. Cien.
Agr. 36(4): 403-408.
63. Rossi, JP; J Mathieu; M Cooper & M Grimaldi. 2006. Soil macrofaunal
biodiversity in Amazonian Pastures: Matching sampling with
Patterns. Soil Biol. Biochem. 38: 2178-2187.
64. Rousseau, L; S Fonte; O Téllez; R van der Hoekc & P Lavelle. 2013.
Soil macrofauna as indicators of soil quality and land use impacts
in smallholder agroecosystems of western Nicaragua. Ecol. Indic.
27: 71-82.
65. Saavedra de C. E; DE Florez & HC Fernández. 2007. Capacidad de
depredación y comportamiento de Alpaida (Araneae: Araneidae)
en cultivo de arroz. Rev. Colomb. Entomol. 33(1): 74-76.
66. Salmona, S; J Mantela; L Frizzerab & A Zanellac. 2006. Changes in
humus forms and soil animal communities in two developmental
phases of Norway spruce on an acidic substrate. Forest Ecol. Manag.
237(1-3): 47-56.
67. Samu, F & C Szinetár. 2002. On the nature of agrobiont spiders. J.
Arachnol. 30: 389-402.
68. Siqueira, GM; EFF Silva & J Paz-Ferreiro. 2014. Land use intensification
effects in soil arthropod community of an Entisol in Pernambuco
State, Brazil. The Scientific World Journal 1-7.
69. Schmidt, MH; I Roschewitz; C Thies; & T Tscharntke. 2005. Differential
effects of landscape and management on diversity and density of
ground-dwelling farmland spiders. J. Appl. Ecol. 42: 281-287.
70. Schmidt, M & T Tscharntke. 2005a. Landscape context of sheetweb
spider (Araneae: Linyphiidae) abundance in cereal fields. J. Biogeog.
32: 46-473.
71. Tapia, CS; B Pashanasi & D Castillo. 2002. Estudio preliminar de la
macrofauna del suelo en áreas de varillales y chamizales de la Amazonia
Peruana. OLIA AMAZONICA 13(1-2): 65-86.
72. Tsiafouli, MA; E Thebault; SP Sgardelis; PC de Ruiter; WH van der Putten;
K Birkhofer; L Hemerik; FT de Vries; RD Bardgett; MV Brady; L
Bjornlund; H Bracht Jörgensen; S Christensen; T D’Hertefeldt; S Hotes;
WHG Hol; J Frouz; M Liiri; SR Mortimer; H Setala; J Tzanopoulos; K
Uteseny; V Pizl; J Stary; V Wolters & K Hedlund. 2015. Intensive
agricultura reduces soil biodiversity across Europe. Global Change
Biology 21(2): 979-985.
73. Universidad Nacional del Litoral (UNL). 2016. Santa Fe. Clima. Disponible: http://www.unl.edu.ar/santafe/index.php/geografia/clima.html. Fecha de último acceso: 10/02/2016.
74. Vallet, P & T Perot. 2011. Silver fir stand productivity is enhanced when
mixed with Norway spruce: evidence base don large-scale inventory
data and a generic modeling approach. J. Veg. Sc. 22: 932-942.
75. Vasconcelos, HL. 2008. Formigas do solo nas Florestas da Amazonia:
Padroes de diversidade e respostas aos disturbios naturais e antrópicos. Em: FMS Moreira, JO Siqueira e L Brussaard (eds). Biodiversidade do
solo em ecosistemas brasileiros. Universidade Federal de Lavras. Lavras,
Brazil. 768 pp.
76. Vasconcellos, A; AG Bandeira; FM Moura; VF Araújo; AB Gusmao & R Constantino. 2010. Termite assemblages in three hábitats under
defferent disturbance regimes in the semi-arid Caatinga of NE Brazil. J. Arid Environ. 74: 298-302.
77. Vasconcellos, RLF; JC Segat; JA Bonfim; D Baretta & EJBN Cardoso.
2013. Soil macrofauna as an indicator of soil quality in an
undisturbed riparian forest and recovering sites of different ages. Eur. J. Soil Biol. 58, 105-112.
78. Vásquez Vela, ALM. 2014. Valoración comparativa de la macrofauna
de lombrices en sistemas agroforestales de café orgánico y convencional en contraste con cultivos en pleno sol y bosque, durante la época lluviosa y seca en Turrialba, Costa Rica. Tesis presentada en opción al grado de Magister Scientiae en Agroforestería
Tropical. Centro Agronómico Tropical de Investigación y Enseñanza. Escuela de Posgrado. Turrialba, Costa Rica. 99 pp.
79. Velásquez, E; P Lavelle & M Andrade. 2007. GISQ, a multifunctional
indicator of soil quality. Soil Biol. Biochem. 39: 3066-3080.
80. Velásquez, E; P Lavelle; C Rendeiro; M Martins; S Barot & M Grimladi.
2009. Cambios en las comunidades de plantas influenciados por la
macroagregación del suelo a través de las actividades de la macrofauna
del suelo en la Amazonia brasileira. http://www.iamazonia.org.br/conteudo/eventos/biodiversidadedesolo/pdf/Resumos/Painel3_VelasquezE.pdf. Fecha de último acceso: 20/11/2015.
81. Walkley, A & IA Black. 1934. An examination of the degtjareff method
for determining soil organic matter, and a proposed modification
of the chromic acid titration method. Soil Sc. 37(1): 29-38.
82. Xiuqin, Y & Z Tingcheng. 2001. Study of the diversity of soil animal’s
community in the Songnen plain grassland of China. XIX
International Grassland Congress. Brasil. 23 pp.
83. Zerbino, MS; N Altier; A Morón & C Rodríguez. 2008. Evaluación de
la macrofauna del suelo en sistemas de producción en siembra
directa y con pastoreo. Agrociencia 12(1): 44-55.
84. Zerbino, MS. 2011. La macrofauna del suelo y su relación con la heterogeneidad florística. En: Bases Ecológicas y Tecnológicas para el
manejo de pastizales. Ed. Unidad de Comunicación y Transferencia de tecnología del INIA. Montevideo, Uruguay. 98-111.






