FERTILIDAD DE SUELOS Y NUTRICIÓN VEGETAL
Adubação fosfatada com torta de filtro, fosfato natural e biofertilizantes em ultisol (argissolo)
Phosphate fertilization with filter cake, natural phosphate and biofertilizers in an ultisol
Gustavo Caione1*, Leónides Castellanos González2, Renato de Mello Prado3,
Alfredo Reyes Hernández4, Leandro Rosatto Moda3,
Enrique Parets Selva5, Ely Nahas3
1 Universidade do Estado de Mato Grosso - UNEMAT , Câmpus de Alta Floresta, MT, Brasil
2 Facultad de Ciencias Agrarias. Universidad de Pamplona. Carretera a Bucaramanga. Norte de Santander. Colombia
3 Universidade Estadual Paulista; Câmpus de Jaboticabal, SP, Brasil.
4 Facultad Agropecuaria de Montaña del Escambray. Universidad de Sancti Spiritus, Cuba
5 Facultad de Ciencias Agrarias. Universidad de Cienfuegos. Cuba
* Autor de contacto: gcaione@unemat.br
Recibido: 21/08/2017
Recibido con revisiones: 03/01/2018
Aceptado: 06/01/2018
Resumen
O uso de biofertilizante combinado com composto orgânico e fontes naturais de fósforo pode resultar em maior eficiência da
adubação. Objetivou-se avaliar o efeito da torta de filtro associada com fosfato natural de rocha e biofertilizantes, sobre a
população de microrganismos do solo, os teores de fósforo no solo, nas plantas e a produção de matéria seca da cultura do
milho. O experimento foi realizado em casa de vegetação utilizando-se milho cultivar DKB 390 VTPRO II, cultivado em vasos
de 5 dm3 contendo Ultisol (Argissolo Vermelho Amarelo Distrófico). Avaliaram-se sete tratamentos, sendo: controle (somente
o solo); solo adicionado de fosfato de rocha (FR); torta de filtro; FR e torta de filtro; FR, torta de filtro e Biopack Sc®; FR,
torta de filtro e Embrafós: FF organic Plus® e; FR, torta de filtro e Azotofos. O delineamento experimental foi o inteiramente
casualizado, com três repetições. Avaliaram-se a altura de plantas, diâmetro do colmo, número de folhas por planta, massa
seca das plantas, populações dos microrganismos no solo e o teor de fósforo do solo e nas plantas. Os solos com torta de
filtro, fosfato natural e biofertilizantes apresentaram maior população de bactérias totais; porém, não aumentaram a massa
seca, o teor de fósforo no solo e o acúmulo de fósforo na parte aérea das plantas quando comparado somente ao uso da
torta de filtro e fosfato natural. A torta de filtro na adubação promoveu maior teor de fósforo no solo e acúmulo pelas plantas,
maior crescimento das plantas e maior população microbiana do solo, em relação aos tratamentos com ausência de torta.
Palavras chave: Adubação organomineral; fósforo; microrganismos; Zea mays.
Abstract
The use of biofertilizers combined with organic compost and natural sources of phosphorus may result in increased fertilizer
efficiency. The aim was to evaluate the effect of the use of the filter cake with natural rock phosphate and biofertilizers on
the population of microorganisms of the soil, the content of phosphorus in soil and plants and the production of dry matter
of corn crop. The experiment was developed at greenhouse, using corn DKB 390 VTPRO II cultivar, sowed in pots of 5 dm3 containing Ultisol. Seven treatments were evaluated: only the soil; soil with phosphate rock (PR); filter cake; PR with filter
cake; PR with filter cake and Biopack Sc®; PR with filter cake and Embrafós: FF organic Plus® and PR with filter cake and
Azotofos. The experimental design was completely randomized, with three repetitions. The height, diameter of the stem,
number of leaves and dry biomass of the plants, and the populations of microorganisms were determined, the content of
phosphorus in soil and plants was also determined. The soils with filter cake, natural phosphate and biofertilizers presented
higher population of total bacteria; however, they did not increase the mass dries, the phosphorus concentration in the soil
and accumulation of phosphorus in the aerial part of the plants when compared only to the use of filter cake and natural
phosphate. The filter cake in the fertilization promoted higher phosphorus content in the soil and accumulation for the plants,
higher growth of the plants and microbial population in the soil, in relation to the treatments with filter cake absence.
Key words: Organomineral fertilization; phosphorus; microorganisms; Zea mays.
INTRODUÇÃO
O fósforo (P) é um elemento essencial ao crescimento
e produção das plantas, as quais necessitam
de um adequado suprimento nutricional para
proporcionarem altas produtividades (Marschner,
1995). Porém, em solos tropicais, altamente intemperizados,
a eficiência da adubação fosfatada
é baixa, devido, principalmente a alta capacidade
de adsorção de P pelo solo.
Como alternativa para aumentar a eficiência
da adubação fosfatada, destaca-se o uso de
um carregador orgânico, como a torta de filtro,
para proteger o P da adsorção (Bittencourt et al.,
2006) e a utilização de microrganismos solubilizadores
de fosfato (Alves et al., 2002), aumentando
o teor de P disponível do solo.
A adubação orgânica nas culturas em geral,
não constitui prática comum no Brasil e, desta
forma, demonstrações da sua importância no manejo
do solo devem ser reforçadas, principalmente
para os produtores que dispõem de compostos
orgânicos na propriedade (Fernandes, 2006).
Agroindústrias sucroalcooleiras têm como subproduto
da produção a torta de filtro, um material
orgânico, obtido pelo processo de clarificação do
caldo da cana-de-açúcar que pode trazer efeitos
benéficos nas propriedades físicas, químicas e
biológicas do solo. Na sua composição elementar
destaca-se o P, o nitrogênio (N), o cálcio (Ca) e o
potássio (K) (Arzola e Fundora, 2008).
A torta de filtro tem sido empregada em substituição
parcial a adubação fosfatada mineral, dependendo
da dose de P recomendada (Santos et
al., 2010; Almeida Júnior et al., 2011, Caione et
al., 2015); porém, diante do baixo teor de P dos
solos tropicais (Novais et al., 2007) e devido a
torta não conter alto teor de P é necessário seu
enriquecimento com fonte mineral deste nutriente.
A escolha da fonte de P baseia-se na eficiência
em suprir o nutriente para as plantas e na
relação custo/benefício da adubação (Goedert et
al., 1986). Estudos têm sido realizados para aumentar
a disponibilidade do P no solo, porém,
tornam-se importantes as pesquisas com o emprego
de microrganismos e fontes alternativas de
P (Mendes e Reis Júnior, 2003).
A população de microrganismos possui habilidade
de mineralizar fosfatos orgânicos e solubilizar
fosfatos inorgânicos, havendo estudos em
diferentes sistemas de cultivo e tipos de solo no
Brasil, informando um grande potencial de fungos
e bactérias (Nahas et al.,1994 a,b).
Diante do elevado custo de fabricação de fosfatos
solúveis têm-se incentivado o uso de fontes
alternativas de P (Prochnow et al., 2004). Os
fosfatos naturais são fertilizantes que apresentam
baixa disponibilidade de P para as plantas em
curto prazo; porém, com custo por unidades de
P mais baixos que os fosfatos solúveis (Novais et
al., 2007).
Alternativamente tem-se a possibilidade do uso
de fertilizante organomineral a partir da mistura de
fosfato natural e uma fonte de carbono, como a torta
de filtro. Na literatura os resultados sobre o uso de
microrganismos solubilizadores de P são contraditórios
em experimentos de campo e casa de vegetação,
pois a eficiência de solubilização depende da
estirpe do microrganismo, fosfato, cultivar, acidez e
natureza da matéria orgânica que servirá como fonte
de carbono para os microrganismos (Nahas et al.,
1994 a,b; Nahas, 2002).
Informações sobre o efeito da torta de filtro
associada ao fosfato natural e microrganismos
na disponibilidade de P no solo, na população
de microrganismos e resposta da planta são incipientes
no Brasil. Existem dúvidas na literatura se
a capacidade dos microrganismos solubilizadores
de fosfato seria suficiente para competir como outros
estabelecidos na rizosfera, fazendo com que
a quantidade do P liberada seja suficiente para
aumento do crescimento vegetal (Richardson et
al., 2009).
Objetivou-se avaliar o efeito do uso da torta
de filtro associada com fosfato natural de rocha
e biofertilizantes, sobre a população de microrganismos
do solo, os teores de fósforo do solo e das
plantas e a produção de matéria seca da cultura
do milho.
MATERIAL E MÉTODOS
O experimento foi realizado na Universidade
Estadual Paulista (UNESP), Câmpus de Jabotica bal, SP, Brasil, em casa de vegetação. Utilizou-se
como planta teste o milho, cultivar DKB 390 VTPRO
II, cultivada em vasos com capacidade para
5 dm3 (altura 23 cm, diâmetro inferior 19 cm e
diâmetro superior 23 cm) contendo Ultisol (Argissolo
Vermelho Amarelo Distrófico). A caracterização
química desse solo, conforme metodologia
de Raij et al. (2001), foi a seguinte: pH em CaCl2
=4,5; M.O. (g dm-3) = 6; P resina (mg dm-3) =
1; K (mmolc dm-3) = 1,4; Ca (mmolc dm-3) = 10;
Mg (mmolc dm-3) = 7; H+Al (mmolc dm-3) = 28;
SB (soma de bases) (mmolc dm-3) = 18,4; CTC
(capacidade de troca catiônica) (mmolc dm-3) =
46,4 e V (saturação por bases) (%) = 40. Aos
30 dias antes da semeadura, realizou a calagem,
objetivando elevar a saturação por bases do solo
para 60%. Em todos os tratamentos foram aplicados
nitrogênio (200 mg dm3), na forma de ureia
(45% de N) e potássio (150 mg dm-3), na forma
de cloreto de potássio (60% de K2O).
O experimento foi constituído por sete tratamentos
dispostos em delineamento inteiramente
ao acaso, com três repetições. Os tratamentos
foram: (1) somente o solo (tratamento-controle);
(2) solo adicionado de fosfato de rocha (FR); (3)
torta de filtro; (4) FR e torta; (5) FR, torta e Biopack
Sc®; (6) FR, torta e Embrafós: FF organic
Plus® e (7) FR, torta e Azotofos.
A unidade experimental foi composta por
vaso, contendo duas plantas. Foram utilizados os
biofertilizantes sólidos: Biopack Sc®, com carga
microbiana de 106 ufc g-1; Embrafós: FF organic
Plus®, com carga microbiana de 104 ufc g-1; e
Azotofos (Pseudomonas fluorescense + Azotobacterr
chococcum), obtido no Laboratório Barajagua,
Instituto de Pesquisas de Solos e Adubos,
Cuba, com carga microbiana de 106 ufc g-1.
A caracterização microbiológica da torta de
filtro foi feita pela inoculação em meio de Bunt
e Rovira (1955), pH 7,4 para contagem de bactérias,
meio de Martin (1950), pH 5,6 para contagem
de fungos e meio Pikoskaya (Martínez et
al., 2006), para contagem de microrganismos
solubilizadores de fosfato. Os resultados foram de
2,97x105, 2,5x102 e 2,5x103 ufc g-1 para bactérias
totais, microrganismos solubilizadores de
fosfato e fungos totais, respectivamente.
A análise química da torta de filtro realizada
conforme metodologia proposta por Bataglia et
al. (1983), apresentou os seguintes resultados:
N= 1,40%; P= 1,17% K= 0,22%; Ca= 2,74%;
Mg= 1,08%; S= 0,24% e M.O. total= 29,6%.
As doses de biofertilizantes foram equivalentes
a 692 kg ha-1 para o Biopack; 500 kg ha-1 para o Embrafós e 70 kg ha-1 para o Azotofos,
seguindo indicações técnicas. Para a ativação dos
microrganismos adicionou 200 mL de água em
um recipiente juntamente com a torta de filtro +
biofertilizante de cada tratamento, em suas respectivas
doses. Deixou-se em aeração por 12 h.
Após este período, aplicou-se os biofertilizantes
ativados e homogeneizou-se novamente.
A dose de torta utilizada (enriquecida ou não
com microrganismos) foi de 12,5 g dm-3 de solo.
A dose de fósforo empregada foi de 60 mg dm-3 de P solúvel em ácido cítrico, na forma de fosfato
natural de Araxá (4% de P2O5 solúvel em ácido
cítrico).
Foram realizadas três avaliações de crescimento
da cultura do milho, aos 14, 28 e 42 dias
após a emergência. Foi determinada a altura de
plantas (nível do solo até base da primeira folha
totalmente expandida), diâmetro do colmo (5 cm
do nível do solo) e número de folhas nas plantas
de cada vaso. Aos 45 dias foi determinado o teor
de fósforo disponível no solo, conforme metodologia
descrita por Raij et al. (2001) e coletaram-se
toda a parte aérea e raízes das plantas do vaso.
O material vegetal foi lavado, acondicionado em
sacos de papel e seco em estufa de circulação
forçada de ar na temperatura de 65 a 70ºC, durante
aproximadamente 96 horas, até atingir a
massa constante. Após secas, as amostras foram
pesadas e determinada a massa seca por vaso.
Posteriormente, essas amostras foram moídas em
moinho tipo Willey e realizada a determinação
do teor de fósforo, de acordo com a metodologia
descrita por Bataglia et al. (1983). Com base na
produção de massa seca da parte aérea por vaso
e teor de fósforo na massa seca, calculou-se o
acúmulo de fósforo na parte aérea das plantas.
Após a coleta das plantas, realizou-se a contagem
dos microrganismos no solo empregando-se
os mesmos procedimentos descritos anteriormente para a caracterização microbiológica da torta
de filtro. Foram adicionados 10,0 g de solo a um
Erlenmeyer contendo 95 mL de uma solução de
pirofosfato de sódio 0,1% (p/v) e após agitação
por 30 minutos, em uma mesa agitadora, foram
feitas diluições decimais em série, de 10-1 a 10 -
10. As placas foram incubadas à temperatura de
30ºC por 48 horas (bactérias), 72 horas (fungos)
e 96 horas (microrganismos solubilizadores de
fosfato), em seguida foram avaliadas em um contador
de colônias com 6x de aumento.
Os dados foram submetidos à análise de variância,
utilizando o programa estatístico SPSS
para Windows version 15. As médias foram comparadas
pelo teste de Tukey (p<0,05). Para as
populações de microrganismos os dados foram
transformados em logaritmo para obter normalidades
destes. Foi realizada análise de correlação
linear entre o teor do P no solo e o acúmulo de P
na parte aérea da planta.
RESULTADOS E DISCUSSÃO
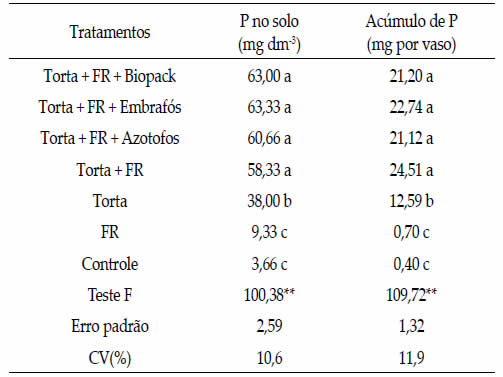
Os maiores teores de P disponível no solo e seu
acúmulo na parte aérea das plantas ocorreram
nos tratamentos com torta de filtro e adição de
fosfato natural, independentemente se enriquecidos
ou não com biofertilizantes (Tabela 1). Na
ausência da torta, o uso do fosfato não aumentou
o teor de P no solo e o acúmulo do nutriente na
planta não diferindo do tratamento-controle. Houve
correlação positiva altamente significativa (r=
0,95**) entre o teor do P no solo e o acúmulo de
P na parte aérea da planta, indicando a importância
do P disponível no solo e a absorção do
nutriente pelas plantas.
O uso exclusivo da torta foi mais importante
como fonte de P para as plantas do que o apenas
fosfato de rocha, verificando-se significativo aumento
do conteúdo de P no solo e nas plantas em
relação ao controle (Tabela 1). Este fato ocorreu
devido a torta apresentar em sua composição,
1,17% de P e, na dose deste composto orgânico
(12,5 g de torta dm-3 de solo), correspondeu a
146 mg dm-3 de P. Vale ressaltar que o P contido
na torta de filtro encontra-se na forma orgânica
sendo apenas parte dele mineralizado nos primeiros
meses após sua aplicação. Além disso, a
torta poderia potencializar a atividade de outros
microrganismos nativos do solo, incluindo as micorrizas,
entre outras, pois Nahas et al. (1994
a,b) relataram que existem populações nativas de
microrganismos no solo (bactérias e fungos) com
grande potencial na solubilização do P. Foi demonstrado
o papel da torta de filtro como fonte de
P no solo, conforme relatado por Arzola e Fundora
(2008). Santos et al. (2010) e Almeida Júnior
et al. (2011) também verificaram a melhoria na
fertilidade do solo com o uso da torta enriquecida
com fosfato acidulado.
Tabela 1. Fósforo disponível no solo e acúmulo na parte
aérea de plantas de milho adubado com torta de filtro, fosfato
natural de Araxá e biofertilizantes.
Table 1. Phosphorus available in the soil and concentration in
the aerial part of maize plants fertilized with filter cake, Araxá
natural phosphate and biofertilizers.
Médias seguidas de letras distintas nas colunas, diferem entre
si pelo teste de Tukey (p<0,05). **: significativo (p<0,01). FR:
fosfato de rocha de Araxá. CV: coeficiente de variação.
Means followed by distinct letters in the columns, differ by
Tukey’s test (p <0.05). **: significant (p <0.01). FR: Araxá rock
phosphate. CV: coefficient of variation.
A utilização da torta com fosfato natural e biofertilizantes
não proporcionaram aumento na disponibilidade
de P no solo e no acúmulo pela planta,
em relação ao tratamento apenas com torta de
filtro e fosfato de rocha, provavelmente devido ao
curto tempo de experimentação (Tabela 1).
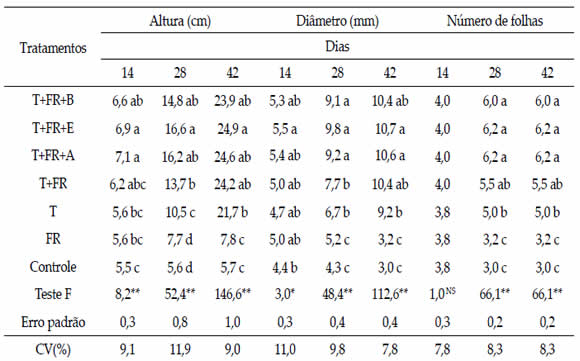
De forma geral, o uso da torta com fosfato de
rocha e biofertilizantes não resultou em maior altura
das plantas, diâmetro de colmos e número
de folhas, em relação ao tratamento com torta e
fosfato de rocha (Tabela 2). Portanto, a partir dos
resultados referentes às variáveis de crescimento da cultura do milho, nota-se que a associação da
torta de filtro com o fosfato de rocha promoveu
melhor desenvolvimento inicial das plantas; resultado
não observado para os tratamentos com
a utilização isolada de torta de filtro ou da rocha
fosfatada.
Tabela 2. Altura, diâmetro do colmo e número de folhas de plantas de milho, em função da aplicação de torta de filtro, rocha
fosfatada e biofertilizantes.
Table 2. Height, stem diameter and number of leaves of maize plants, as a function of the application of filter cake, phosphate rock
and biofertilizers.
Médias seguidas de letras distintas nas colunas, diferem entre si pelo teste de Tukey (p<0,05). **; * e NS: significativo (p<0,01);
(p<0,05) e não significativo, respectivamente. T: Torta de filtro; FR: fosfato de rocha de Araxá; B: Biopack; E: Embrafós; A: Azotofos.
CV: coeficiente de variação.
Means followed by distinct letters in the columns, differ by Tukey’s test (p <0.05). **; * and NS: significant (p <0.01); (p <0.05) and not
significant, respectively. T: Filter cake; FR: Araxá rock phosphate; B: Biopack; E: Embrafós; A: Azotofos. CV: coefficient of variation.
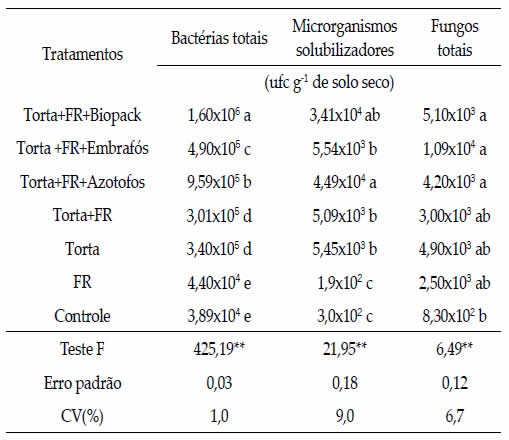
As populações de bactérias totais aumentaram
com o uso da torta, rocha fosfatada e biofertilizantes
quando comparados com os demais tratamentos;
entretanto o uso do Biopack, seguido do Azotofos,
proporciou a maior população bacteriana em relação
ao Embrafós (Tabela 3). Este fato pode ser devido à
incorporação de uma maior carga de bactérias (106 ufc g-1) por estes biofertilizantes.
Para a população de microrganismos solubilizadores
de fosfato (Tabela 3), os maiores resultados
foram obtidos com os tratamentos que
continham torta de filtro, em relação à ausência
de torta, o qual se explica pela incorporação de
microrganismos solubilizadores de fosfato através
da torta (2,5x102 ufc g-1). Ressalta-se, também,
que o tratamento com o uso de Azotofos, que não
diferiu do Biopack, apresentou melhor resultado.
No entanto, estes resultados não refletiram em
maior teor de P no solo com estes tratamentos
(Tabela 1), possivelmente devido ao curto período
de condução do ensaio.
As populações de fungos foram pouco influenciadas,
havendo maior número de unidades formadoras
de colônias com a presença de torta de
filtro; no entanto, sem diferir apenas do tratamento
com rocha fosfatada (Tabela 3). Nahas et al.
(1994 c) também observaram que o uso de fosfato
natural de Araxá incrementou a população de
fungos, em relação ao controle sem aplicação de
P em um Latossolo Vermelho-Escuro.
Evidenciou-se que a adição de torta de filtro
promoveu melhores condições para o crescimento
da população de bactérias, em comparação à
aplicação isolada de rocha fosfatada. Este fato
deve-se as cepas incorporadas com a torta, ou,
o favorecimento da ação dos microrganismos nativos
do solo que proporciona maior capacidade
de solubilizar o P, conforme relatado por Nahas et
al. (1994 a,b). Em geral, se verificou a influência
de matéria orgânica no solo sobre a população
de microrganismos, conforme relatado por outros
autores (Ferreira et al., 2017).
Tabela 3. Populações de microrganismos aos 45 dias, em função
da aplicação de torta de filtro, fosfato natural de Araxá e
biofertilizantes.
Table 3. Populations of microorganisms at 45 days, depending
on the application of filter cake, Araxá natural phosphate and
biofertilizers.
Médias seguidas de letras distintas nas colunas, diferem entre
si pelo teste de Tukey (p<0,05). **: significativo (p<0,01). FR:
Fosfato natural de Araxá. UFC: Unidades formadoras de
colônias. CV: coeficiente de variação.
Means followed by distinct letters in the columns, differ by
Tukey’s test (p <0.05). **: significant (p <0.01). FR: Natural
phosphate from Araxá. UFC: Colony forming units. CV:
coefficient of variation.
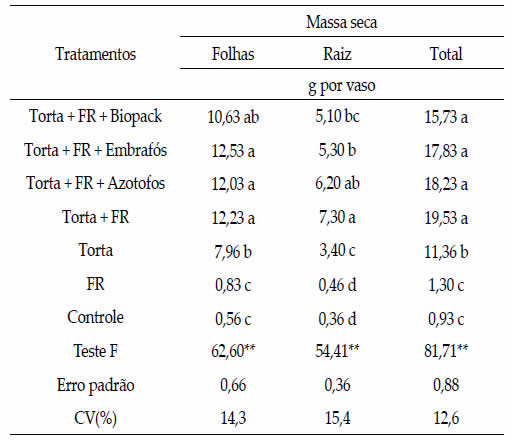
Foram observados maiores valores para a massa
seca foliar e total das plantas para os tratamentos
que receberam torta com fosfato natural, independentemente
da presença ou da ausência de
biofertilizantes, exceto para massa seca foliar em
que o tratamento apenas com torta não diferiu do
tratamento com Biopack (Tabela 4). Este fato deve-
se aos efeitos destes tratamentos nas variáveis
de crescimento, aos 42 dias após a emergência
(Tabela 2). Houve maior produção de massa seca
das raízes com torta e fosfato de rocha, seguido de
torta, fosfato de rocha e Azotofos (Tabela 4).
Tabela 4. Massa seca das plantas de milho, em função da
aplicação de torta de filtro, rocha fosfatada e biofertilizantes.
Table 4. Dry mass of maize plants, according to the application
of filter cake, phosphate rock and biofertilizers.
Médias seguidas de letras distintas nas colunas, diferem entre
si pelo teste de Tukey (p<0,05). **: significativo (p<0,01). FR:
Fosfato natural de Araxá. CV: coeficiente de variação.
Means followed by distinct letters in the columns,
differ by Tukey’s test (p <0.05). **: significant
(p <0.01). FR: Natural phosphate from
Araxá. CV: coefficient of variation.O teor de P no
solo correlacionou-se positivamente com a população
de bactérias totais (r = 0,91**), microrganismos
solubilizadores de fosfato (r=0,82**) e
com a população de fungos (r = 0,73**). Houve correlação positiva, também, entre o acúmulo de
P na parte aérea com população de bactérias totais
(r= 0,91**), microrganismos solubilizadores
de fosfato (r= 0,82**) e com a população de fungos
(r = 0,62**). Isto demonstra que as bactérias
desempenharam papel mais importante na disponibilização
de P no solo e, consequentemente,
absorção pelas plantas do que a população de
fungos, apresentando maiores coeficientes de correlação.
Uma reflexão realizada sobre o tema disponibilidade
do P no solo com o uso de microrganismos
(Mendes e Reis Júnior, 2003) indicou muitas
contradições e necessidades de trabalhar em esforço
concentrado em pesquisas pela obtenção de
estirpes de alta capacidade de solubilização de P.
CONCLUSÕES
O solo com torta de filtro, fosfato natural e biofertilizantes
apresentaram maior população de bactérias
totais; porém, não aumentaram a massa seca,
o teor de fósforo no solo e o acúmulo de fósforo na
parte aérea das plantas quando comparado somente
ao uso da torta de filtro e fosfato natural.
A torta de filtro na adubação promoveu maior
teor de fósforo no solo e acúmulo pelas plantas,
maior crescimento das plantas e maior população
microbiana do solo, em relação aos tratamentos
com ausência de torta.
BIBLIOGRAFIA
1. Almeida Júnior, AB; CWA Nascimento; MF Sobral; FBV Silva
& WA Gomes. 2011. Fertilidade do solo e absorção
de nutrientes em cana-de-açúcar fertilizada com torta de
filtro. Revista Brasileira de Engenharia Agrícola e Ambiental
15: 1004-1013.
2. Alves, L; EA Mendoza & GN Silva Filho. 2002. Microrganismos
solubilizadores de fosfatos e o crescimento de Pínus
e Eucalipto. Revista Brasileira de Ciência do Solo 26:
939-947.
3. Arias, LM. 2015. Deficiencias de fósforo y potasio en maíz.
Efectos sobre el área foliar, crecimiento y absorción de
nutrientes. Tesis en opción al título de master en Ciencias
de suelo. Universidad de Buenos aires. Disponível
em: <http://lacs.ipni.net/ipniweb/region/lacs.nsf/e0f08
5ed5f091b1b852579000057902e/7310afb32c629
18a032579030053e4a5/$FILE/TESIS%20MSc%20
LM%20%20Arias%20Usandivaras.pdf>. Acessado em:
10 de agosto de 2016.
4. Arzola, N & O Fundora. 2008. Suelos, Fertilizantes y Enmiendas.
Editorial Universo Sur. Universidad de Cienfuegos.
Cuba. 312pp.
5. Bataglia, OC; AMC Furlani; JPF Teixeira; PR Furlani & JR Gallo.
1983. Métodos de análise química de plantas. Campinas:
Instituto Agronômico (Boletim Técnico, 78). 48pp.
6. Bittencourt, VC; AC Strini; LG Cesarim & SR Souza. 2006.
Torta de filtro enriquecida. Revista Idea News 6: 2-6.
7. Bunt, JS & AD Rovira. 1955. Microbiological studies of some
subantartic soils. J. Soil Science 6: 119-128.
8. Ferreira, EPB; LF Stone & CCG Martin-Didonet. 2017. População
e atividade microbiana do solo em sistema agroecológico
de produção. Revista Ciência Agronômica 48:
22-31.
9. Fernandes, MS. 2006. Nutrição Mineral de Plantas. 1.ed. Viçosa:
UFV (Sociedade Brasileira de Ciência do Solo). 432 pp.
10. Goedert, WJ; DMG Souza; E Lobato. 1986. Fósforo. In: Goedert,
WJ. (Ed.) Solos dos cerrados: Tecnologias e estratégias
de manejo. São Pablo. Nobel. 126-166 pp.
11. Marschner, H. 1995. Mineral nutrition of higher plants. 2
ed. London: Academic. 889pp.
12. Martin, JP. 1950. Use of acid, rose bengal, and streptomycin
in the plate method for estimating soil fungi. Soil Science
69: 215-232.
13. Martínez Viera, R; M López; FM Brossard; GG Tejeda; AH Pereira;
ZC Parra; SJ Rodríguez & A Alba. 2006. Procedimientos
para el estudio y fabricación de Biofertilizantes
bacterianos. Maracay. Venezuela. Instituto Nacional de
Investigaciones Agrícolas. 88pp.
14. Mendes, IC & FB Reis Júnior. 2003. Microrganismos e disponibilidade
de fósforo (P) nos solos: uma análise crítica.
EMBRAPA, Planaltina. 26 pp.
15. Nahas, E; JF Centurion & LC Assis. 1994a. Microrganismos
solubilizadores de fosfato e produtores de fosfatases de
vários solos. Revista Brasileira de Ciência do Solo 18:
43-48.
16. Nahas, E; JF Centurion & L.C. Assis. 1994b. Efeito das características
químicas dos solos sobre os microrganismos
solubilizadores de fosfato e produtores de fosfatases. Revista
Brasileira de Ciência do Solo 18: 49-53.
17. Nahas, ED; J Fornasierei & LC Assis. 1994c. Resposta a
Inoculação de fungo solubilizador de fósforo em milho.
Scientia Agricola 51: 463-469.
18. Nahas, E. 2002. Microrganismos do solo produtores de fosfatases
em diferentes sistemas agrícolas. Bragantia 61:
267-275.
19. Novais, RF; TJ Smyth & FN Nunes. 2007. Fósforo. In: Novais,
RF; VVH Alvarez; NF Barros; RLF Fontes; RB Cantarutti
& JCL Neves. (Ed). Fertilidade do solo. SBCS.
Viçosa. 1017pp.
20. Novais, RF & TJ Smyth. 1999. Fósforo em solos e plantas
em condições tropicais. Viçosa, MG, Universidade Federal
de Viçosa. 399p.
21. Prochnow, LI; JC Alcarde & SH Chien. 2004. Eficiência
agronômica dos fosfatos totalmente acidiculados. In:
Yamada, T; SRS Abdalla. (Eds.) Fósforo na agricultura
brasileira. Piracicaba, Potafos: 605-651.
22. Raij, B van; JC Andrade; H Cantarella & JA Quaggio. 2001.
Análise química para avaliação da fertilidade dos solos
tropicais. Campinas, Instituto Agronômico, 285pp.
23. Richardson, AE; JM Barea; AM McNeill & C Prigent-Combaret.
2009. Acquisition of phosphorus and nitrogen in the
rhizosphere and plant growth promotion by microorganisms.
Plant and Soil 321: 305-339.
24. Santos, DH; CS Tiritan; JSS Foloni & LB Fabris. 2010. Produtividade
de cana-de-açúcar sob adubação com torta
de filtro enriquecida com fosfato solúvel. Pesquisa Agropecuária
Tropical 40: 454-461.
25. Santos, DH; MA Silva; CS Tiritan; JSS Foloni & FR Echer.
2011. Qualidade tecnológica da cana-de-açúcar sob
adubação com torta de filtro enriquecida com fosfato
solúvel. Revista Brasileira de Engenharia Agrícola e Ambiental
15: 443-449.



