[article pii="nd" doctopic="oa" language="es" ccode="CAICYT" status="1" version="4.0" type="ilus tab" order="05" seccode="cds060" sponsor="nd" stitle="Cienc. suelo" volid="36" issueno="2" dateiso="20180800" fpage="50" lpage="61" pagcount="12" issn="1850-2067"]BIOLOGÍA DEL SUELO
[front][titlegrp][title language="es"]Efectos de la labranza en la estructura y la actividad biológica a nivel de los microagregados del suelo[/title]
[title language="en"]Effects of tillage systems on microbial structure and activity at microaggregate level[/title][/titlegrp]
[authgrp][author role="nd" rid="a01"][fname]Juan Pablo[/fname] [surname]Frene[/surname][/author]1, [author role="nd" rid="a01"][fname]Luciano Andrés[/fname] [surname]Gabbarini[/surname][/author]1, [author role="nd" rid="a01"][fname]Luis Gabriel[/fname] [surname]Wall[/surname][/author][/authgrp]1*
1. [aff id="a01" orgname="Universidad Nacional
de Quilmes"]Universidad Nacional de Quilmes[/aff]
*Autor de contacto: wall.luisgabriel@gmail.com
[bibcom][hist]Recibido: [received
dateiso="20171126"]26/11/2017[/received]
Recibido con revisiones: [revised
dateiso="20180710"]10/07/2018[/revised]
Aceptado: [accepted
dateiso="20180712"]12/07/2018[/accepted][/hist]
RESUMEN
[abstract language="es"]El conocimiento de la distribución de
los microorganismos y la actividad enzimática en las fracciones de agregados
del suelo con manejo agrícola puede contribuir a comprender mejor los servicios
ecosistémicos del suelo. El objetivo de este trabajo fue evaluar el efecto de
los sistemas de labranza (siembra directa y labranza convencional) sobre la
abundancia de microorganismos (hongos y bacterias) y la actividad biológica del
suelo a nivel de los microagregados del suelo. Los estudios se replicaron en
suelos de dos sitios ambientalmente diferentes de la región pampeana. Las
muestras fueron tamizadas en húmedo, obteniéndose las siguientes fracciones de
agregados: 2000-63, 63-20, 20-2 y 2-0,1 μm. La abundancia de bacterias y
hongos fue medida por qPCR encontrándose diferente abundancia según el tamaño
de agregados. Los perfiles fisiológicos a nivel de comunidades se diferenciaron
según el tamaño de agregados independientemente del sistema de labranza y del
sitio muestreado. Por el contrario, a nivel de agregados los perfiles de
actividad enzimática se agruparon principalmente por el sistema de labranza y
no por el tamaño de los mismos. Estos resultados nos permiten sugerir que la
provisión de servicios ecosistémicos del suelo es el resultado de una
integración de la estructura física a nivel de agregados y la actividad
bioquímica propia de éstos.[/abstract]
Palabras claves: [keygrp scheme="nd"][keyword type="m" language="es"]enzimas[/keyword], [keyword type="m" language="es"]clpp[/keyword], [keyword type="m" language="es"]manejos agricolas[/keyword], [keyword type="m" language="es"]fracciones de agregado de suelo[/keyword][/keygrp]
ABSTRACT
[abstract language="en"]The knowledge
of the distribution of microorganisms and the enzymatic activitiy at the level
of soil fractions aggregates would contribute to a better understanding of the
ecosystemic services of the soil. The objective of this work was to determine
if two of the most relevant microbial groups, fungi and bacteria, and the
biological activity of the soil measured as a respiratory profile induced by
substrates and / or the activity of extracellular enzymes, were modified by
differential tillage systems, and if that modification was reproduced at the
microaggregate level of the soil. Two agricultural farming practices were
compared: no-tillage and conventional tillage. The studies were replicated in
soils of two different environmentally sites of the Pampean region. The samples
were wet sieved, obtaining the following fractions of aggregates: 2000-63, 63-20,
20-2 and 2-0.1 μm. The
abundance of bacteria and fungi was estimated by qPCR, finding different
abundances according to the size of the aggregates. The physiological profiles
at the community level were differentiated according to the aggregates size independently
of the tillage management and the sampled site. On the contrary, at the level
of aggregates, the enzymatic profiles were differentiated more by soil tillage
than by the size of the fraction. These results allow us to suggest that soil
ecosystemic services are the result of an integration of the physical structure
at the level of aggregates and their own biochemical activities.[/abstract]
Key words: [keygrp scheme="nd"][keyword type="m" language="en"]enzymes[/keyword], [keyword type="m" language="en"]clpp[/keyword], [keyword type="m" language="en"]agriculture managements[/keyword], [keyword type="m" language="en"]soil aggregates fractions[/keyword][/keygrp][/bibcom][/front]
[body]INTRODUCCIÓN
Los diferentes manejos que se realizan en los suelos bajo producción agrícola, modifican su estructura biológica y por consiguiente, los servicios ecosistémicos del suelo (Roldán et al., 2005). La labranza convencional (LC) es un sistema de laboreo donde los residuos de los cultivos son incorporados al suelo por la acción del arado o la rastra de discos. Este sistema de labranza se realiza con la intención de introducir la materia orgánica, remover malezas, airear el suelo, reducir la compactación y controlar las plagas que afectan a los cultivos con la finalidad de incrementar la germinación de las semillas y el rendimiento de los cultivos (Raper et al., 2000). Sin embargo, también se sabe que la LC favorece la erosión del suelo por pérdida de materia orgánica debido a un aumento de los procesos de mineralización, disminuye la infiltración del agua y genera pérdida de la estructura física, disminuyendo la calidad del suelo debido a la fragmentación de los agregados del mismo (Allmaras et al., 2000). En contraposición, la siembra directa (SD) es una práctica de manejo utilizada con el fin de preservar la estructura física e incrementar el carbono (C) almacenado en el suelo, de este modo se proporciona un hábitat y sustratos de mayor calidad para la biota mejorando la biofertilidad del suelo (Holland, 2004). En síntesis, diferentes sistemas de labranza influyen diferencialmente sobre las propiedades del suelo, incluyendo la distribución de las fracciones de agregados del suelo y los sustratos disponibles (Six et al., 2006; Tiemann et al., 2015)
El proceso de agregación es un proceso dinámico, en el cual los microagregados se unen entre sí por medio de raíces, hongos, polímeros orgánicos y residuos. A su vez, los microagregados contribuyen a la formación de los macroagregados (Tisdall & Oades, 1982, Lehmann et al., 2017). Cada fracción de agregados constituye un microambiente con características físicas, químicas y estructurales únicas que influyen sobre las comunidades microbianas que allí habitan (Mummey et al., 2006).
Las comunidades microbianas del suelo tienen un rol integral en prácticamente todos los servicios ecosistémicos, incluyendo el ciclado de los nutrientes y la descomposición de la materia orgánica (Trivedi et al., 2017). La tasa con la cual se llevan a cabo estos procesos está regulada principalmente por aquellos microorganismos que se encuentran presentes en las diferentes fracciones de agregados (Davinic et al., 2012). Sin embargo, poco se sabe sobre como los sistemas de labranza influyen en las comunidades microbianas y su funcionamiento a una escala de microagregados, más propia de los microorganismos (Ettema & Wardle, 2002). Conocer y comprender la distribución de los microorganismos del suelo y su actividad biológica a una escala menor quizás permita comprender mejor los efectos de los diferentes sistemas de labranza y sus efectos sobre los servicios ecosistémicos y la productividad de los suelos a largo plazo (Kandeler et al., 1999; Salinas-Garcia et al., 1997)
El objetivo en este trabajo fue analizar el efecto de sistemas de labranzas contrastantes en la distribución cuali y cuantitativa de las comunidades microbianas y su actividad bioquímica a nivel de diferentes fracciones de tamaños de agregados. Las hipótesis de trabajo son: i) la abundancia de los microorganismos (hongos y bacterias) y las respuestas bioquímicas son condicionadas por el tamaño de la fracción de agregados, ii) el sistema de labranza afecta la distribución de las fracciones de agregados, y iii) que los manejos de labranza no modifican la abundancia de los hongos y bacterias ni las respuestas bioquímicas en las diferentes fracciones de agregados.
MATERIALES Y MÉTODOS
Descripción de los sitios
Los suelos analizados corresponden a dos establecimientos agrícolas de diferentes zonas de la región pampeana. El primer caso corresponde a un experimento de larga duración que se encuentra en establecimiento Hogar Funke, localizado en Tornquist (Provincia de Buenos Aires, Argentina; 38°09'S 61°57'O). El suelo es un Argiudol Típico (264 mg kg-1 arcilla, 552 mg kg-1 limo, 184 mg kg-1 arena), y es representativo de región pampeana central-sudeste semiárida. La temperatura anual promedio y las precipitaciones son 15 ºC y 800mm, respectivamente. Los sistemas de labranza contrastantes, labranza convencional y siembra directa, fueron establecidos en 1986 en dos parcelas de 8 ha. adyacentes. Los implementos mecánicos utilizados en el sistema de labranza convencional fueron cincel y rastra de disco con una profundidad de 7-20 cm. En ambos manejos agrícolas, la rotación de cultivos y aplicación de agroquímicos fue similar, siendo de este modo la única diferencia entre ambas parcelas el manejo de labranza. Los suelos de Tornquist con SD tuvieron valores de 21,4 mg g-1 de COT y en la LC de 18,6 mg g-1. Los valores de fosforo extraíble en las muestras bajo SD fueron 66,13 mg kg-1 suelo y en la LC 56,67 mg kg-1 suelo. El pH en ambos manejos agrícolas fue 6. El segundo sitio de muestreo se ubicó en el establecimiento Las Matreras, localizado en Irineo Portela (Provincia de Buenos Aires; 33º58'S 59º40'O). El ensayo de SD tiene 15 años de historia y se maneja con una rotación de cultivos típica para la zona, trigo/ soja-maíz-soja. El campo bajo LC corresponde a un establecimiento vecino a Las Matreras que se venía trabajando con este sistema de labranza al momento del muestreo y sobre el cual no tenemos mayor información de su historia de uso. El caso de estudio en Irineo Portela se incluyó para corroborar si los resultados obtenidos a nivel de microagregados en el ensayo controlado y de larga duración de Tornquist eran observables en otro ambiente edafo-climático con manejo de labranzas similares. Los casos de suelos analizados en la zona de Irineo Portela corresponden a un Argiudol Típico (261 mg kg-1 arcilla, 568 mg kg-1 lime, 171 mg kg-1 arena), del tipo franco arcilloso limoso. El suelo de la zona constituye una unidad fisiográfica (Pampa ondulada) caracterizada por un relieve predominantemente ondulado y recortado en parte por cañadas, arroyos y ríos, donde sobresalen una serie de elevaciones divisorias de aguas, interfluvios y áreas de nacientes. La temperatura anual promedio y las precipitaciones fueron 17ºC y 1070 mm, respectivamente. Los suelos de ambos sistemas de labranza presentaron valores de 42,4 mg g-1 de COT, 66,8 mg kg-1 de fosforo extractable y un pH de 5,8.
Las muestras fueron recolectadas de los primeros cinco centímetros de suelo (0-5 cm) en julio de 2014 para las muestras de Tornquist y en mayo de 2015 para las muestras de Irineo Pórtela. En cada tratamiento se tomaron cinco muestras separadas por al menos 50 metros. Para cada una de las muestras, se tomaron 25 piques de barreno (2 cm de diámetro) en un área de 5 m2, que se mezclaron para generar la muestra compuesta. Posteriormente, las muestras fueron transportadas con geles refrigerantes y una vez en el laboratorio una parte de cada muestra se almacenó a 4ºC para su fraccionamiento y determinaciones bioquímicas dentro de los dos primeros meses posteriores al muestreo. Otra parte equivalente fue secada a 40ºC, para las determinaciones químicas.
Fraccionamiento del suelo
Para la separación de las fracciones de micro agregados de diferentes tamaños del suelo se realizó el procedimiento descripto por Stemmer et al.(1998) y modificado posteriormente por Neumann et al. (2013). El suelo se separó en cuatro fracciones de agregados (2000-63, 63-20, 20- 2, 2-0,1 μm). Para ello, se tomó una cantidad de suelo conservado a 4ºC equivalente a una masa de 20 g de peso seco que se suspendió en agua desionizada (suelo/agua: 1:5 p/v) y se trató con ultrasonido con una energía de 30 J/mL ("UltrasonicCleaner",Testlab S.R.L., Argentina). La fracción de 2000-63 μm (arena) fue separada del resto de las fracciones por medio del tamizado de la suspensión de suelo a través de una malla de 63 μm. El líquido filtrado por la malla, que arrastra todas las partículas menores a 63 μm fue centrifugado a 50 g durante 15 min a 4ºC (Centrifuga Refrigerada Multi-RF; Thermo Fischer Scientific, EEUU). Para separar la fracción de 2-0,1 μm (arcillas) de la fracción 63-2 μm (limosa), el sobrenadante de la centrifugación conteniendo la fracción 2-0,1 μm fue conservado en un vaso de precipitado y el precipitado fue re-suspendido en agua desionizada y vuelto a centrifugar. La centrifugación y resuspensión del precipitado se repitió ocho veces más, con tiempos de centrifugación decrecientes, 15, 13, 12 y 11 min por duplicado cada uno de ellos, respectivamente. Posterior a la última centrifugación, el precipitado fue tamizado en húmedo con un tamiz con malla de 20 μm, separando así la fracción de agregados 20-2 μm (limosa fina) que atraviesa el tamiz, de la fracción 63-20 μm (limosa gruesa) que queda retenida. Para aumentar la floculación de las partículas menores a 2 μm, se agregó Cloruro de Magnesio (MgCl2), con una concentración final de 3,3 mM, al contenido de los vasos de precipitados donde se recogieron todos los sobrenadantes de los procesos de resuspensión-centrifugación y se incubaron a 4ºC durante 16 h. Posteriormente, las partículas < 2 μm fueron concentradas por centrifugación durante 10 min a 2400 g. Todas las fracciones se secaron a 40ºC y luego se determinaron las fracciones de los agregados por pesada. Finalmente, las muestras se almacenaron a 4º C en heladera hasta su uso.
Extracción de ADN EL ADN microbiano del suelo sin fraccionar y de las fracciones de agregados fue extraído y purificado a partir de 0,25 g de las muestras utilizando el kit de extracción ZR Soil Microbe DNA MiniPrep ™ (Zymo Research Corporation, EEUU) de acuerdo al protocolo del fabricante. La cantidad y la calidad de ADN extraído se determinó por medio de un espectrofotómetro Nano Drop ND-1000 spectrophotometer (Thermo Fischer Scientific, EEUU), determinando las relaciones de absorbancia 260/280 nm y 230/260 nm.
Cuantificación de los grupos microbianos principales por qPCR
La abundancia de las copias de la subunidad pequeña de gen ribosomal del ARN de bacterias y hongos fueron cuantificados usando el protocolo y los oligonucleótidos descripto por Fierer et al., (2005). Para hongos, el oligonucleótido usado fue 5.8s (5'-CGTTGCGTTCTTCATCG-3') combinado con el oligonucleótido ITS1f (5'-TCCGTAGGTGAACCTGCGG- 3'), mientras que para bacterias se usaron los oligonucleótidos Eub338 (5'-ACTCCTACGGGAGGCAGCAG-3') y Eub518 (5'-ATTACCGCGGCTGCTGG-3'). Para estimar la abundancia se generaron curvas patrón usando diluciones seriadas a partir de una concentración conocida de ADN extraído de Pseudomonaprotegens CHAØ o de Fusarium oxysporumpara bacterias y hongos, respectivamente. El volumen final de la reacción de real time-PCR fue 25 μl-12,5 μl de Master MixqPCR SYBR (PB-L, Argentina),3μl dedeoxi-nucleótidos,0,75 μl de cada oligonucleótido iniciador (10 μM), y 7μl de agua estéril libre de ADN-. En cada reacción se agregó1μl de las muestras de ADN de suelo o el ADN utilizado como curva de calibración. La reacción fue llevada a cabo en un ciclador Smart Cycler (Cepheid, EEUU) usando el programa: 94°C durante 15 min seguido por 40 ciclos de 30 s a 94° C, 30 s a 50° C y 30 s a 72°C; se utilizó la misma temperatura de hibridación para hongos y bacterias. Se llevaron a cabo curvas de hibridación y geles electroforéticos para confirmar que los productos amplificados fuesen del tamaño adecuado. El número de copias de cada gen bacteriano o fúngico fue generado usando una ecuación de regresión para cada ensayo relacionando el valor del ciclo umbral (Ct) para conocer el número de copias en los patrones con una concentración conocida de ADN por medio del programa Lin-RegPCR (Ruijter et al., 2015). Todas las reacciones de qPCR fueron corridas por triplicados para cada ADN extraído de las muestras de suelo con el fin de obtener un valor promedio.
Análisis de la actividad de enzimas extracelulares (EAA)
El análisis de la actividad potencial de enzimas hidrolíticas se realizó mediante ensayos en placas de 96 celdas o pocillos, por fluorescencia (Marx et al., 2001) en suelo sin fraccionar y en distintas fracciones de microagregados. Las muestras de suelo fueron ensayadas como fuente de enzimas para las siguientes actividades enzimáticas: β-cellobiohidrolasa (CEL), N-acetil-β- glucosaminidasa (NAG), β-glucosidasa (BG), fosfatasa (PME), y arilsulfatasa (SUL).
La suspensión de suelo sin fraccionar y de las fracciones de agregados analizadas se realizó agregando 0,1 g de suelo a un tubo de 20 ml (BMT-20 S, IKA, Alemania) junto con 10 esferas de acero de 5 mm de diámetro en 10 ml de buffer MES (ácido etanolsulfónico2-[N-Morfolino]; Sigma, E.E.U.U.) estéril 0,1M y pH 6,1. La suspensión se homogenizó con la ayuda del ULTRA TURRAX®Tube Drive (IKA, Alemania) que agitó las esferas de acero durante dos minutos a 6000 rpm y temperatura ambiente. La suspensión de suelo generada fue inmediatamente utilizada para medir las cinéticas enzimáticas. Para realizar el ensayo se descargaron 200 ml de suspensión de suelo por pocillo con micropipeta automática de 8 canales en una placa de 96 pocillos. La turbidez propia del suelo y los compuestos fenólicos que contiene disminuyen en cierto grado la intensidad de la fluorescencia del fluorósforo 4-metilumbelliferona (4-MUB;Marx et al., 2001). El grado en que se apaga esta señal varía para los diferentes suelos por lo tanto se realizó una corrección para cada suelo (muestra + 4-MUB). Además, en cada placa se incluyó la mezcla de reacción de la muestra por triplicado para cada una de las concentraciones de sustrato (muestra + sustrato), un control de sustrato (sustrato + buffer) y un control de muestra (muestra + buffer). El volumen final de la mezcla de reacción en cada pocillo fue de 250 ml. La fluorescencia de los controles se restó al valor de las muestras. Como estándar se utilizó 4-MUB en concentración final de 2 μM en el pocillo. Los sustratos 4-MUB-Fosfato, 4-MUB-β-D-cellobiosa, 4-MUB-N-acetil- β-D-glucosamina, 4-MUB-β-D-glucopiranosa, y 4-MUB-sulfato (Sigma, E.E.U.U.) se disolvieron en agua estéril y las concentraciones finales en los pocillos fueron de 40μM.
La intensidad de la fluorescencia se leyó a 355 nm ya 460 nm de longitud de onda de excitación y de emisión, respectivamente, en el lector de fluorescencia para placas (POLARstar Omega, BMG LABTECH, Alemania). El lector fue programado para realizar 25 ciclos de lectura de 60 seg a 30 ºC. Las actividades enzimáticas se calcularon como la cantidad de sustrato hidrolizado por unidad de tiempo y se expresó en nmol de 4-MUB producidos por hora y por gramo de suelo seco.
Análisis de los Perfiles Fisiológicos a Nivel de las Comunidades (CLPP) de suelo.
Para este ensayo se utilizaron unas placas de 96 pocillos previamente preparadas con un sistema biosensor de oxígeno para los análisis fisiológicos de suelo (Garland et al., 2003) que diseñamos y construimos de acuerdo al trabajo de McLamore et al. (2014). Las suspensiones de suelo fueron preparadas mezclando 1 g de suelo con 5 ml de agua destilada estéril en un tubo de 15 ml conteniendo aproximadamente 5 ml de perlitas de metal de 2 mm para mezclado y homogenizado mediante ULTRA TURRAX Tube Drive (IKA, Alemania) durante 20 min. Las fuentes de C seleccionadas fueron el ácido p-cumárico, ácido propiónico y ácido vaníllico (Sigma-Aldrich Co. Ltd.). Las fuentes de carbono utilizadas como sustrato se eligieron de acuerdo a trabajos previos (Zabaloy, 2008, Frene et al., 2014) siendo estos los sustratos que mayor diversidad de respuestas mostraron entre tratamientos, probablemente por constituir fuentes de carbono cuya degradación implica rutas metabólicas particulares, resaltando las diferenciaciones de respuesta a nivel de comunidades microbianas complejas. Las soluciones madre de fuente de C (300 mg L-1) fueron preparadas para obtener una concentración final en el pocillo de 50 mg L-1de C. Todas las soluciones stocks y el agua destilada fueron esterilizadas utilizando filtros (<0,22 μm, Sartor, EEUU) y almacenados a 4º C previos a ser ensayadas en las microplacas.
En cada pocillo se agregaron 40 μl de las soluciones de las fuentes de C o agua desionizada estéril para determinar la respiración inducida por sustrato o la respiración basal, respectivamente. En cada pocillo, se agregaron160 μl de las suspensiones de suelo con la adición 40 μl de agua desionizada estéril hasta un volumen final de 240 μl.
Los datos de las cinéticas de fluorescencia de los consumos de oxigeno fueron expresados como unidades de fluorescencia relativa normalizados (UFRN).Los valores de UFRN se obtuvieron dividiendo el valor de fluorescencia en cada punto por el valor de fluorescencia medido una hora después de haber comenzado el ensayo. El tiempo mínimo de respuesta (TMR) fue definido como el tiempo necesario para alcanzar un valor de 1,1 de UFRN. El pico de la respuesta fluorescente (Fmax) fue calculado para todas las muestras como otro parámetro de la actividad respiratoria, asumiendo una tasa de difusión constante.
Análisis Estadístico
Las medias de los parámetros calculados para los tratamientos y las fracciones de agregados del suelo fueron analizadas por medio del test Análisis de la Varianza ANOVA, previa corroboración de los supuestos de normalidad y heterocedasticidad. Las comparaciones de medias se realizaron con el LSD de Fisher (P < 0,05). Los datos experimentales fueron analizados y visualizados utilizando un análisis multivariado de coordenadas principales (ACoP), ya que este posibilita cuantificar la distancias euclideas entre las muestras. Todos los análisis estadísticos fueron realizados con el software INFOSTAT (Di Rienzo et al., 2013).
RESULTADOS
Distribución de las fracciones de agregados
Los suelos de Tornquist presentaron la mayor proporción de agregados en la fracción 2000-63 μm (Figura 1), siendo significativamente mayor en las muestras de SD que en las muestras de LC (P = 0,019), seguido por la fracción 63-20 μm, donde las muestras de la LC presentaron valores significativamente mayores que las muestras de SD (P = 0,028). Las fracciones 20-2 μm y 2-0,1 μm no presentaron diferencias significativas entre los sistemas de labranza.
En los suelos de Irineo Pórtela (Figura 1), en las fracciones 2000-63 μm y 63-20 μm no se presentaron diferencias significativas entre los sistemas de labranza, siendo la fracción 63-20 μm la que presentó la mayor proporción en ambos casos. En la fracción 20-2 μm, las muestras de la LC mostraron valores mayores que la SD (P = 0,025). Por último, la fracción 2-0,1 μm no presentó diferencias significativas entre tratamientos.

Figura 1. Proporción de cada
fracción de tamaño de agregados, 200-63 mm, 63-20 mm, 20-2 mm, 2-0,1 mm, sobre
el total de suelo recuperado en el fraccionamiento de suelo de Tornquist y de
Irineo Portela.
Figure
1.
Amount of each aggregates size fraction, 200-63 mm, 63-20 mm, 20-2 mm, 2-0,1
mm, and total sum of aggregate fractions from soil samples of Tornquist and
Irineo Portela.
Análisis de las actividades biológicas de los suelos sin fraccionar
En una primera etapa se analizaron los perfiles de enzimas y CLPP de los suelos sin fraccionar (SSF) buscando diferencias de acuerdo al sistema de labranza (Figura 2). En el Análisis de Coordenadas Principales (ACoP) de los perfiles enzimáticos para los suelos de Tornquist las muestras se separaron por sistema de labranza (Figura 2A). De forma similar, el ACoP basado en los datos del CLPP también diferenció los suelos de Tornquist de acuerdo al sistema de labranza (Figura 2B). En el ACoP basado en el perfil enzimático de las muestras de Irineo Pórtela (Figura 2C) las muestras también se agruparon por sistema de labranza y lo mismo ocurre cuando se analizó el ACoP basado en los datos de CLPP de esos suelos (Figura 2D).

Figura 2. Análisis de
Coordenadas Principales (ACoP) de las muestras de suelo sin fraccionar basados
en a) perfil enzimático para Tornquist, b) CLPP para Tornquist, c) perfil
enzimático para Pórtela y d) CLPP para Irineo Portela (n=3).
Figure
2.
Principal Coordinate Analysis (PCoA) from bulk soil samples based on for a)
enzymatic profile for Tornquist, b) CLPP for Tornquist, c) enzymatic profile
for Irineo Portela, and d) CLPP for Irineo Portela (n = 3).
Abundancia de hongos y bacterias a nivel de microagregados
En las muestras de Tornquist, no hubo diferencias significativas entre fracciones ni entre tratamientos para las abundancias de los microorganismos medidos (Tabla 1).
En las muestras de Irineo Pórtela, SD presentó mayor abundancia bacteriana en las fracciones 2000-63, 63-20 y 2-0,1 μm (P = 0.015, P = 0.0149, P = 0.0001 respectivamente) respecto a LC. Bajo LC los mayores valores de abundancia bacteriana se encontraron en la fracción 20-2 μm (Tabla 1).
Tabla 1. Abundancia de
bacterias y hongos (n = 5). Los valores con idéntica letra no se diferencian
significativamente (P< 0,05). Las letras mayúsculas representan las
diferencias entre fracciones de tamaños agregados dentro de cada tratamiento y
letras minúsculas entre tratamientos para cada sitio y fracción de agregados.
Table
1.
Bacteria and fungi abundance (n = 5). The values with identical letters do not
differ significantly (P <0.05). Capital letter represents differences within
soil aggregate size fractions and the lowercase between treatments for site and
soil aggregate fractions.
SD =
Siembra directa; LC = Labranza convencional; SSF = % de recuperación del
fraccionamiento respecto del suelo sin fraccionar.
SD
= No-tillage; LC = Conventional tillage; SSF = % of bulk soil recovery after
fractionation.

LC =
labranza convencional; SD = siembra directa.
LC = conventional tillage; SD = No-tillage
La abundancia de los hongos no presentó diferencias significativas entre tratamientos ni fracciones en ninguno de los dos sitios.
Actividades enzimáticas a nivel de microagregados.
En las muestras de Tornquist en SD, las actividades de la enzimas β-glucosidasa (BG) fueron mayores tanto en la fracción de 2000-63 mm como la de 63-20 mm respecto a las de 20-2 mm y 2-0.1 mm. La actividad de N-acetil- β-glucosaminidasa (NAG) fueron mayores en la fracción 2000-63 μm respecto a las actividades en las fracciones 20-2 (Figura 3). Estas enzimas presentaron una disminución de su actividad específica desde la fracción 2000-63 μm hasta la fracción 20-2μm. La actividad de fosfatasa (PME) no mostró diferencias significativas relevantes entre fracciones, salvo para la fracción 2-0.1 mm que tuvo valores significativamente menores respecto a las otras fracciones. La actividad de la β-cellobiohidrolasa (CEL) y la arilsulfatasa (SUL) presentaron las mayores actividades en la fracción 2-0,1 μm. Por otro lado, en las muestras de Tornquist en LC, la actividad de la enzima BG fue mayor en la fracción 2000-63 μm en relación a la fracción 2-0.1 μm y disminuyendo su valor con el tamaño de la fracción. Las actividades de NAG y PME no mostraron diferencias significativas relevantes entre fracciones en general salvo para el caso de NAG cuya actividad en la fracción 63-20 μm fue significativamente menor que la de 2-0,1 μm; la actividad de CEL y SUL resultó superior en la fracción 2-0,1 μm. Cuando se compara entre sistemas de labranza para el sitio de Tornquist solo se encontraron diferencias significativas, con valores mayores en SD que en LC, para la actividad BG en la fracción 2000-63 μm (P = 0,047) y la actividad SUL en la fracción 2-0,1 μm (P = 0,028).

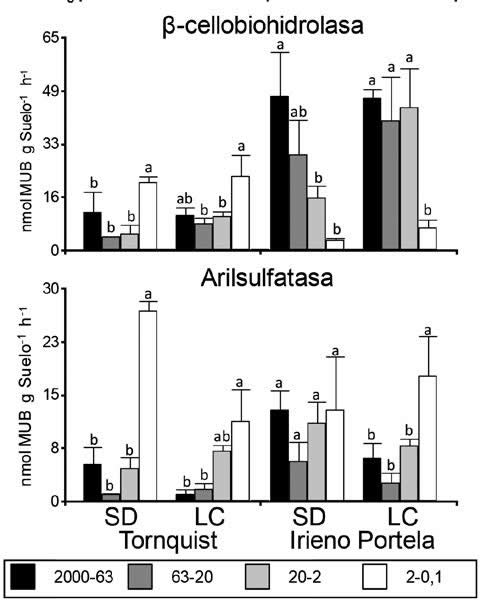
SD = Siembre
directa; LC = labranza convencional.
SD = No-tillage; LC = conventional tillage.
Figura 3. Actividad enzimática para cada fracción de tamaño de agregados
del suelo y sitio. Las barras de error representan el error estándar y las
letras marcan diferencias significativas (P<0.05) entre las fracciones de
agregados para cada tratamiento y sitio(n = 5).
Figure
3.
Enzymatic activity for each soil aggregate fractions and site. Error bars
represented standard error and letters point differences between soil
aggregates fractions for each treatment and site(n=5).
En las muestras de Irineo Portela (Figura 3) se verifica una mayor actividad enzimática general respecto de las actividades de los suelos de Tornquist (P< 0,0001 para todas las actividades enzimáticas con excepción de SUL donde no hubo diferencias significativas). En comparación al resto de las fracciones en el mismo suelo, las muestras presentaron mayor actividad para las cinco enzimas en la fracción 2000-63 μm en SD y las actividades de BG, NAG y CEL disminuyeron con el tamaño de fracción. En las muestras en LC, la actividad de PME fue mayor en la fracción 20-2 μm respecto al resto de las fracciones, y la actividad de la CEL fue alta y similar en las tres fracciones de mayor tamaño. Finalmente, la SUL mostró la mayor actividad en la fracción 2-0,1 μm. No se presentaron diferencias significativas en la actividad enzimática entre los sistemas de labranza en ninguna fracción de agregados.
En el análisis multivariado ACoP del perfil enzimático de las fracciones de agregados provenientes de ambos sistemas de labranza para los suelos de Tornquist (Figura 4A), encontramos que las muestras de mayor tamaño, 2000-63 μm y 63-20 μm tienden a agruparse por sistema de labranza mientras que las de menor tamaño 20-2 y 2-0,1 μm tienden a agruparse por tamaño de fracción.
En el ACoP del perfil enzimático de las fracciones de agregados provenientes de Irineo Portela (Figura 4B) las muestras presentaron menor separación de acuerdo al sistema de labranza que lo observado en las muestras de Tornquist (Figura 4A). Las fracciones de agregados de 63-20 μm y 2000-63 μm se ubicaron cercanas entre sí, mientras que ambas fracciones de 2-0,1 μm se separaron del resto de las fracciones de agregados en cercanía con la fracción 20-2 μm perteneciente a la SD (Figura 4B).

LC = labranza
convencional; SD = siembra directa.
LC = conventional tillage; SD = No-tillage
Figura 4. Análisis de Coordenadas Principales del perfil enzimático de las
muestras de las fracciones de agregados para A) Tornquist, B) Irineo Pórtela
(n=10).
Figure
4.
Principal Coordinate Analysis of the enzymatic profile from soil aggregates
fraction samples for A) Tornquist, B) Irineo Portela (n = 10).
Análisis de los perfiles fisiológicos (CLPP) a nivel de microagregados.
El análisis multivariado ACoP, de los perfiles fisiológicos de las diferentes fracciones arrojó un resultado diferente a lo observado para los perfiles enzimáticos (Figura 5). En el caso de Tornquist (Figura 5A), las muestras tienden a agruparse por tamaño de fracción más que por el sistema de labranza. Las fracciones de agregados 2000- 63 μm y 63-20 μm presentaron las menores distancias entre sistema de labranza. Por otro lado, ambas fracciones de 2-0,1 μm se separaron del resto de las fracciones de agregados.

LC = labranza
convencional; SD = siembra directa.
LC = conventional tillage; SD = No-tillage.
CLPP = Perfil fisiológico a nivel de comunidades microbianas;
CLPP= Microbial community level physiological profile
Figura 5. Análisis de Coordenadas Principales para el CLPP de las
muestras de las fracciones de agregados para a) Tornquist y b) Irineo Pórtela
(n=10).
Figure
5.
Principal Coordinate Analysis of CLPP from soil aggregates fraction samples for
A) Tornquist, B) Irineo Portela (n = 10).
En el ACoP de las muestras de suelo de Irineo Portela (Figura 5B), las muestras se agruparon de acuerdo al tamaño de fracción principalmente, y solo se separa del resto la fracción de 2-0,1 μm perteneciente a la LC.
DISCUSIÓN
Las comunidades microbianas determinan en gran medida la actividad bioquímica de los suelos. El mecanismo primario por el que los sistemas de labranzas influyen sobre las comunidades microbianas del suelo es a través de la transformación de la estructura del suelo y la disponibilidad de substratos (Elliott & Coleman, 1988). Los datos obtenidos en este trabajo en un primer análisis del suelo sin fraccionar muestran que dos sistemas de labranza contrastantes modifican en forma diferencial el perfil bioquímico del suelo como han sugerido otros autores (Kandeler et al., 1999). Esta observación se verifica tanto a nivel de actividad de enzimas del suelo como de perfiles fisiológicos a nivel de comunidades microbianas. A partir de esta diferencia surgió la pregunta sobre lo que sucede a nivel de los microagregados de diferente tamaño, resistentes al tamizado en húmedo de los suelos, para profundizar en el conocimiento de la relación estructura y función de los suelos.
El conocimiento de las comunidades microbianas dentro de cada microambiente (fracciones de agregados) es de interés científico para poder comprender mejor los mecanismos que conducen los procesos de ciclado de los nutrientes en el suelo, los cuales tienen importantes implicaciones en la provisión de servicios ecosistémicos (Grundmann et al., 2004). La determinación de la abundancia relativa de hongos y bacterias por qPCR a partir de las fracciones de agregados de diferentes tamaños mostró algunas diferencias dependiendo del tamaño del agregado y del sitio o tipo de suelo. En Tornquist no se encontraron diferencias en las abundancias. En el suelo de Irineo Portela los agregados de 2000-63 mm mostraron diferencias en la abundancia de bacterias respecto del sistema de labranza, con mayor abundancia en los agregados provenientes del suelo en SD y este comportamiento se extendió a la fracción 63-20 mm (Tabla 1). Un reciente análisis de metadatos sugiere la importancia de las bacterias en la agregación de microagregados mientras que los hongos tendrían una mayor participación en la estabilidad de los macroagregados (Lehmann et al., 2017). Este tipo de resultado ha sido explicado como la consecuencia de una mayor protección física para los microorganismos en este tamaño de fracción (Lagomarsino et al., 2012; Sessitsch et al., 2001) donde se encuentran los mayores niveles de C (Neumann et al., 2013). De todos modos es importante recordar que abundancias equivalentes de los grupos microbiológico pueden contener una estructura diferente en la diversidad microbiológica que resulte en distintas capacidades fisiológicas. Si bien en este trabajo no hemos analizado la diversidad de la estructura microbiológica de bacterias u hongos, las determinaciones de comportamientos diferenciales de los CLPP en los suelos con diferentes labranzas sugieren que las comunidades microbiológicas son diferentes.
A nivel de los agregados, en el caso de Tornquist, el análisis de los CLPP evidenció una agrupación de las muestras por tamaño de agregados, más que por sistema de labranza del suelo, lo que sugiere una comunidad microbiana de características semejantes de acuerdo al tamaño del agregado que sería independiente de ambos sistemas de labranza (SD y LC).
El patrón general de las actividades enzimáticas estaría gobernado por la cantidad y calidad de los sustratos orgánicos (Deng & Tabatabai, 1996). Las diferentes enzimas se encuentran asociadas de manera diferencial con las arcillas o con los residuos de las plantas, dependiendo del mecanismo de estabilización físico-químico y las disponibilidades de los sustratos (Lagomarsino et al., 2012; Allison & Jastrow, 2006; Kandeler et al., 1999). En este trabajo observamos una distribución de las actividades enzimáticas específicas de acuerdo al sistema de labranza a nivel de las diferentes fracciones de microagregados del suelo (Figura 3). En los suelos bajo SD las actividades de las enzimas BG, NAG fueron mayores en las fracciones más grandes de 2000-63 mm y en algunos casos también 63-20 mm y la actividad disminuyó desde las fracciones más grandes a las de menor tamaño, principalmente en los suelos de Irineo Pórtela. Estas diferencias no se observan en las muestras de los suelos bajo LC. Para el caso de SD se ha demostrado que el C orgánico (fresco o lábil) derivado de los residuos de los cultivos es primero incorporado en las fracciones de mayor tamaño (2000-200 μm) durante la descomposición inicial y luego acumulado en las de menor tamaño (Six et al., 2000; Stemmer et al., 1998) Consecuentemente, esto se traduce en un mayor contenido de C y N lábil en las fracciones de mayor tamaño, lo que estimularía una mayor producción de enzimas extracelulares (Qin et al., 2010), resultados que se verifica en las fracciones de 2000-63 μm y 63-20 μm para las enzimas β-glucosidasa y N-acetil-glucosaminidasa (Figura 3) de los ciclos de C y N respectivamente. En concordancia con nuestras observaciones para la enzima β-glucosidasa, Allison & Jastrow (2006) observaron que la mayor actividad de las enzimas relacionadas con el C y P, también analizadas en este trabajo, se encuentran favorecidas en las fracciones mayores a 250 μm, sugiriendo que los microorganismos aquí presentes producen mayores cantidades de enzimas hidrolíticas, con el fin de degradar los materiales derivados de las plantas presentes en mayor abundancia en las fracciones de mayor tamaño en la SD (Marx et al., 2005). La falta de concordancia con las actividades de fosfatasas en nuestros resultados, que no mostraron una mayor actividad en los agregados de mayor tamaño, podría variar de acuerdo a la disponibilidad de P en los diferentes suelos que se comparan. En cambio, en las fracciones de menor tamaño, el C se encontraría protegido por las partículas minerales y consecuentemente tendría una baja disponibilidad microbiana y eso conduciría a una menor actividad enzimática en esas fracciones (Qin et al., 2010). Por el contrario, en el caso de LC, la perdida de la estructura y el aumento de la mineralización del C, especialmente en las fracciones de mayor tamaño que no están protegidas por las arcillas, podría explicar los menores valores enzimáticos encontrados en algunas de las fracciones de mayor tamaño en los suelos de LC al contrario de lo que ocurre en las mismas fracciones de SD.
En líneas generales nuestros resultados concuerdan con lo publicado por Jiang y colaboradores (2011), quienes mostraron que el tamaño de agregados determina el patrón de distribución de la actividad microbiana en el suelo, donde el efecto de la labranza no fue significativo a escala de los microagregados.
CONCLUSIONES
La comparación de suelos bajo diferentes sistemas de labranza, siembra directa y labranza convencional, muestra que el factor mecánico modifica las propiedades bioquímicas del suelo generando diferencias en los perfiles enzimáticos y en los perfiles fisiológicos del mismo. La labranza también modifica las proporciones de microagregados que forman el suelo. Las diferencias bioquímicas por labranza halladas en el suelo sin fraccionar no se observan cuando las mismas son analizadas a nivel de los microagregados. Esto implica que las propiedades bioquímicas de los suelos y las prestaciones ecosistémicas que derivan de ellas, dependen de la proporción de microagregados que generan los diferentes sistemas de labranza.[/body]
[back]AGRADECIMIENTOS
[ack][p]Agradecemos a Cristian Klein y a Belén Agosti por su participación en los muestreos. Este trabajo fue financiado por el Ministerio de Ciencia, Tecnología e Innovación Productiva de Argentina (ANPCYT PAE 36976 y PID53) y la Universidad Nacional de Quilmes (PUNQ R732/11). LA Gabbarini y LG Wall son investigadores de CONICET y JP Frene fue becario Doctoral CONICET durante este trabajo.[/p][/ack]
[other standard="other" count="33"]BIBLIOGRAFIA
[ocitat][no]1[/no]. [ocontrib][oauthor role="nd"][surname]Allison[/surname], [fname]SD[/fname][/oauthor] & [oauthor role="nd"][fname]JD[/fname] [surname]Jastrow[/surname][/oauthor]. [date dateiso="20060000" specyear="2006"]2006[/date]. [title language="en"]Activities of extracellular enzymes in physically isolated fractions of restored grassland soils[/title][/ocontrib]. [oiserial][sertitle]Soil Biol. Biochem.[/sertitle] [issueno]38[/issueno], [pages]3245-3256[/pages][/oiserial].[/ocitat]
[ocitat][no]2[/no]. [ocontrib][oauthor role="nd"][surname]Allmaras[/surname], [fname]RR[/fname][/oauthor]; [oauthor role="nd"][fname]HH[/fname] [surname]Schomberg[/surname][/oauthor]; [oauthor role="nd"][fname]CL[/fname] [surname]Douglas[/surname][/oauthor] & [oauthor role="nd"][fname]TH[/fname] [surname]Dao[/surname][/oauthor]. [date dateiso="20000000" specyear="2000"]2000[/date]. [title language="en"]Soil organic carbon sequestration potential of adopting conservation tillage in US croplands[/title][/ocontrib]. [oiserial][sertitle]J. Soil Water Conserv.[/sertitle] [issueno]55[/issueno], [pages]365-373[/pages][/oiserial].[/ocitat]
[ocitat][no]3[/no]. [ocontrib][oauthor role="nd"][surname]Davinic[/surname], [fname]M[/fname][/oauthor]; [oauthor role="nd"][fname]LM[/fname] [surname]Fultz[/surname][/oauthor]; [oauthor role="nd"][fname]V[/fname] [surname]Acosta-Martinez[/surname][/oauthor]; [oauthor role="nd"][fname]FJ[/fname] [surname]Calderón[/surname][/oauthor]; [oauthor role="nd"][fname]SB[/fname] [surname]Cox[/surname][/oauthor]; [oauthor role="nd"][fname]SE[/fname] [surname]Dowd[/surname][/oauthor]; [oauthor role="nd"][fname]VG[/fname] [surname]Allen[/surname][/oauthor]; [oauthor role="nd"][fname]JC[/fname] [surname]Zak[/surname][/oauthor] & [oauthor role="nd"][fname]J[/fname] [surname]Moore-Kucera[/surname][/oauthor]. [date dateiso="20120000" specyear="2012"]2012[/date]. [title language="en"]Pyrosequencing and mid-infrared spectroscopy reveal distinct aggregate stratification of soil bacterial communities and organic matter composition[/title][/ocontrib]. [oiserial][sertitle]Soil Biol. Biochem.[/sertitle][issueno]46[/issueno], [pages]63-72[/pages][/oiserial].[/ocitat]
[ocitat][no]4[/no]. [ocontrib][oauthor role="nd"][surname]Deng[/surname], [fname]SP[/fname][/oauthor] & [oauthor role="nd"][fname]MA[/fname] [surname]Tabatabai[/surname][/oauthor]. [date dateiso="19960000" specyear="1996"]1996[/date]. [title language="en"]Effect of tillage and residue management on enzyme activities in soils[/title][/ocontrib]. [oiserial][sertitle]Biol. Fertil. Soils[/sertitle] [issueno]22[/issueno], [pages]202-207[/pages][/oiserial].[/ocitat]
[ocitat][no]5[/no]. [omonog][oauthor role="nd"][surname]Di Rienzo[/surname] [fname]JA[/fname][/oauthor], [oauthor role="nd"][fname]F[/fname] [surname]Casanoves[/surname][/oauthor]; [oauthor role="nd"][fname]MG[/fname] [surname]Balzarini[/surname][/oauthor]; [oauthor role="nd"][fname]L[/fname] [surname]Gonzalez[/surname][/oauthor]; [oauthor role="nd"][fname]M[/fname] [surname]Tablada[/surname][/oauthor] & [oauthor role="nd"][fname]CW[/fname] [surname]Robledo[/surname][/oauthor]. [date dateiso="20130000" specyear="2013"]2013[/date]. [title language="es"]InfoStat versión 2013[/title]. [pubname]Grupo InfoStat[/pubname], [othinfo]n.d[/othinfo][/omonog].[/ocitat]
[ocitat][no]6[/no]. [ocontrib][oauthor role="nd"][surname]Elliott[/surname], [fname]ET[/fname][/oauthor] & [oauthor role="nd"][fname]DC[/fname] [surname]Coleman[/surname][/oauthor]. [date dateiso="19880000" specyear="1988"]1988[/date]. [title language="en"]Let the soil work for us[/title][/ocontrib]. [oiserial][sertitle]Ecol. Bull.[/sertitle] [pages]23-32[/pages][/oiserial].[/ocitat]
[ocitat][no]7[/no]. [ocontrib][oauthor role="nd"][surname]Ettema[/surname], [fname]CH[/fname][/oauthor] & [oauthor role="nd"][fname]DA[/fname] [surname]Wardle[/surname][/oauthor]. [date dateiso="20020000" specyear="2002"]2002[/date]. [title language="en"]Spatial soil ecology[/title][/ocontrib]. [oiserial][sertitle]Trends Ecol. Evol.[/sertitle] [issueno]17[/issueno], [pages]177-183[/pages][/oiserial].[/ocitat]
[ocitat][no]8[/no]. [ocontrib][oauthor role="nd"][surname]Fierer[/surname], [fname]N[/fname][/oauthor]; [oauthor role="nd"][fname]JA[/fname] [surname]Jackson[/surname][/oauthor]; [oauthor role="nd"][fname]R[/fname] [surname]Vilgalys[/surname][/oauthor] & [oauthor role="nd"][fname]RB[/fname] [surname]Jackson[/surname][/oauthor]. [date dateiso="20050000" specyear="2005"]2005[/date]. [title language="en"]Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[/title][/ocontrib]. [oiserial][sertitle]Appl. Environ. Microbiol.[/sertitle] [issueno]71[/issueno], [pages]4117-4120[/pages][/oiserial].[/ocitat]
[ocitat][no]9[/no]. [omonog][oauthor role="nd"][surname]Frene[/surname], [fname]JP[/fname][/oauthor]; [oauthor role="nd"][fname]LA[/fname] [surname]Gabbarini[/surname][/oauthor] & [oauthor role="nd"][fname]LG[/fname] [surname]Wall[/surname][/oauthor]. [date dateiso="20140000" specyear="2014"]2014[/date]. [title language="es"]Perfil fisiológico del suelo y discriminación de prácticas agrícolas[/title]. [confgrp][confname]Congreso Argentino de Ciencia del Suelo[/confname], [city]Bahía Blanca[/city], [date dateiso="20140509" specyear="5 al 9 de mayo"]5 al 9 de mayo[/date][/confgrp][/omonog].[/ocitat]
[ocitat][no]10[/no]. [ocontrib][oauthor role="nd"][surname]Garland[/surname], [fname]JL[/fname][/oauthor]; [oauthor role="nd"][fname]MS[/fname] [surname]Roberts[/surname][/oauthor]; [oauthor role="nd"][fname]LH[/fname] [surname]Levine[/surname][/oauthor] & [oauthor role="nd"][fname]AL[/fname] [surname]Mills[/surname][/oauthor]. [date dateiso="20030000" specyear="2003"]2003[/date]. [title language="en"]Community-level physiological profiling performed with an oxyge-sensitive fluorophore in a microtiter plate[/title][/ocontrib]. [oiserial][sertitle]Appl. Environ. Microbiol.[/sertitle][issueno]69[/issueno], [pages]2994-2998[/pages][/oiserial].[/ocitat]
[ocitat][no]11[/no]. [ocontrib][oauthor role="nd"][surname]Grundmann[/surname], [fname]GL[/fname][/oauthor]. [date dateiso="20040000" specyear="2004"]2004[/date]. [title language="en"]Spatial scales of soil bacterial diversity - the size of a clone[/title][/ocontrib]. [oiserial][sertitle]FEMS Micr. Ecol.[/sertitle] [issueno]48[/issueno], [pages]119-127[/pages][/oiserial].[/ocitat]
[ocitat][no]12[/no]. [ocontrib][oauthor role="nd"][surname]Holland[/surname], [fname]JM[/fname][/oauthor]. [date dateiso="20040000" specyear="2004"]2004[/date]. [title language="en"]The environmental consequences of adopting conservation tillage in Europe: reviewing the evidence[/title][/ocontrib]. [oiserial][sertitle]Agric. Ecosyst. Environ.[/sertitle] [issueno]103[/issueno], [pages]1-25[/pages][/oiserial].[/ocitat]
[ocitat][no]13[/no]. [ocontrib][oauthor role="nd"][surname]Jiang[/surname], [fname]X[/fname][/oauthor]; [oauthor role="nd"][fname]AL[/fname] [surname]Wright[/surname][/oauthor]; [oauthor role="nd"][fname]J[/fname] [surname]Wang[/surname][/oauthor] & [oauthor role="nd"][fname]Z[/fname] [surname]Li[/surname][/oauthor]. [date dateiso="20110000" specyear="2011"]2011[/date]. [title language="en"]Long-term tillage effects on the distribution patterns of microbial biomass and activities within soil aggregates[/title][/ocontrib]. [oiserial][sertitle]Catena[/sertitle] [issueno]87[/issueno], [pages]276-280[/pages][/oiserial].[/ocitat]
[ocitat][no]14[/no]. [ocontrib][oauthor role="nd"][surname]Kandeler[/surname], [fname]E[/fname][/oauthor]; [oauthor role="nd"][fname]M[/fname] [surname]Stemmer[/surname][/oauthor] & [oauthor role="nd"][fname]EM[/fname] [surname]Klimanek[/surname][/oauthor]. [date dateiso="19990000" specyear="1999"]1999[/date]. [title language="en"]Response of soil microbial biomass, urease and xylanase within particle size fractions to long-term soil management[/title][/ocontrib]. [oiserial][sertitle]Soil Biol. Biochem.[/sertitle][issueno]31[/issueno], [pages]261-273[/pages].doi:[doi]10.1016/S0038- 0717(98)00115-1[/doi][/oiserial][/ocitat]
[ocitat][no]15[/no]. [ocontrib][oauthor role="nd"][surname]Lagomarsino[/surname], [fname]A[/fname][/oauthor]; [oauthor role="nd"][fname]S[/fname] [surname]Grego[/surname][/oauthor] & [oauthor role="nd"][fname]E[/fname] [surname]Kandeler[/surname][/oauthor]. [date dateiso="20120000" specyear="2012"]2012[/date]. [title language="en"]Soil organic carbon distribution drives microbial activity and functional diversity in particle and aggregate-size fractions[/title][/ocontrib]. [oiserial][sertitle]Pedobiologia [/sertitle][issueno]55[/issueno], [pages]101-110[/pages][/oiserial].[/ocitat]
[ocitat][no]16[/no]. [ocontrib][oauthor role="nd"][surname]Lehmann[/surname], [fname]A[/fname][/oauthor]; [oauthor role="nd"][fname]W[/fname] [surname]Zheng[/surname][/oauthor] & [oauthor role="nd"][fname]MC[/fname] [surname]Rillig[/surname][/oauthor]. [date dateiso="20170000" specyear="2017"]2017[/date]. [title language="en"]Soil biota contributions to soil aggregation[/title][/ocontrib]. [oiserial][sertitle]Nature Ecology & Evolution[/sertitle] [issueno]1[/issueno], [pages]1828-1835[/pages][/oiserial][/ocitat]
[ocitat][no]17[/no]. [ocontrib][oauthor role="nd"][surname]Marx[/surname], [fname]MC[/fname][/oauthor]; [oauthor role="nd"][fname]M[/fname] [surname]Wood[/surname][/oauthor] & [oauthor role="nd"][fname]SC[/fname] [surname]Jarvis[/surname][/oauthor]. [date dateiso="20010000" specyear="2001"]2001[/date]. [title language="en"]A microplate fluorimetric assay for the study of enzyme diversity in soils[/title][/ocontrib]. [oiserial][sertitle]Soil Biol. Biochem.[/sertitle][issueno]33[/issueno], [pages]1633-1640[/pages][/oiserial].[/ocitat]
[ocitat][no]18[/no]. [ocontrib][oauthor role="nd"][surname]McLamore[/surname], [fname]E[/fname][/oauthor]; [oauthor role="nd"][fname]J[/fname] [surname]Garland[/surname][/oauthor]; [oauthor role="nd"][fname]C[/fname] [surname]Mackowiak[/surname][/oauthor]; [oauthor role="nd"][fname]A[/fname] [surname]Desaunay[/surname][/oauthor]; [oauthor role="nd"][fname]N[/fname] [surname]Garland[/surname][/oauthor]; [oauthor role="nd"][fname]P[/fname] [surname]Chaturvedi[/surname][/oauthor]; [oauthor role="nd"][fname]M[/fname] [surname]Taguchi[/surname][/oauthor] [oauthor role="nd"][fname]K[/fname] [surname]Dreaden[/surname][/oauthor]; [oauthor role="nd"][fname]J[/fname] [surname]Catechis[/surname][/oauthor] & [oauthor role="nd"][fname]J[/fname] [surname]Ullman[/surname][/oauthor]. [date dateiso="20140000" specyear="2014"]2014[/date]. [title language="en"]Development and validation of an open source O2-sensitive gel for physiological profiling of soil microbial communities[/title][/ocontrib]. [oiserial][sertitle]J Microbiol Methods[/sertitle] [issueno]96[/issueno]:[pages]62-67[/pages][/oiserial][/ocitat]
[ocitat][no]19[/no]. [ocontrib][oauthor role="nd"][surname]Mummey[/surname], [fname]D[/fname][/oauthor]; [oauthor role="nd"][fname]W[/fname] [surname]Holben[/surname][/oauthor]; [oauthor role="nd"][fname]J[/fname] [surname]Six[/surname][/oauthor] & [oauthor role="nd"][fname]P[/fname] [surname]Stahl[/surname][/oauthor]. [date dateiso="20060000" specyear="2006"]2006[/date]. [title language="en"]Spatial stratification of soil bacterial populations in aggregates of diverse soils[/title][/ocontrib]. [oiserial][sertitle]Microb. Ecol.[/sertitle] [issueno]51[/issueno], [pages]404-411[/pages][/oiserial].[/ocitat]
[ocitat][no]20[/no]. [ocontrib][oauthor role="nd"][surname]Neumann[/surname], [fname]D[/fname][/oauthor]; [oauthor role="nd"][fname]A[/fname] [surname]Heuer[/surname][/oauthor]; [oauthor role="nd"][fname]M[/fname] [surname]Hemkemeyer[/surname][/oauthor]; [oauthor role="nd"][fname]R[/fname] [surname]Martens[/surname][/oauthor] & [oauthor role="nd"][fname]CC[/fname] [surname]Tebbe[/surname][/oauthor]. [date dateiso="20130000" specyear="2013"]2013[/date]. [title language="en"]Response of microbial communities to long-term fertilization depends on their microhabitat[/title][/ocontrib]. [oiserial][sertitle]FEMS Microbiol. Ecol.[/sertitle] [issueno]86[/issueno], [pages]71-84[/pages][/oiserial].[/ocitat]
[ocitat][no]21[/no]. [ocontrib][oauthor role="nd"][surname]Qin[/surname], [fname]S[/fname][/oauthor]; [oauthor role="nd"][fname]C[/fname] [surname]Hu[/surname][/oauthor]; [oauthor role="nd"][fname]X[/fname] [surname]He[/surname][/oauthor]; [oauthor role="nd"][fname]W[/fname] [surname]Dong[/surname][/oauthor]; [oauthor role="nd"][fname]J[/fname] [surname]Cui[/surname][/oauthor] & [oauthor role="nd"][fname]Y[/fname] [surname]Wang[/surname][/oauthor]. [date dateiso="20100000" specyear="2010"]2010[/date].[title language="en"]Soil organic carbon, nutrients and relevant enzyme activities in particlesize fractions under conservational versus traditional agricultural management[/title][/ocontrib]. [oiserial][sertitle]Appl. Soil Ecol.[/sertitle] [issueno]45[/issueno], [pages]152-159[/pages][/oiserial].[/ocitat]
[ocitat][no]22[/no]. [ocontrib][oauthor role="nd"][surname]Raper[/surname], [fname]RL[/fname][/oauthor]; [oauthor role="nd"][fname]DW[/fname] [surname]Reeves[/surname][/oauthor]; [oauthor role="nd"][fname]CH[/fname] [surname]Burmester[/surname][/oauthor] & [oauthor role="nd"][fname]EB[/fname] [surname]Schwab[/surname][/oauthor]. [date dateiso="20000000" specyear="2000"]2000[/date]. [title language="en"]Tillage depth, tillage timing, and cover crop effects on cotton yield, soil strength, and tillage energy requirements[/title][/ocontrib]. [oiserial][sertitle]Appl. Eng. Agric.[/sertitle] [issueno]16[/issueno], [pages]379[/pages][/oiserial].[/ocitat]
[ocitat][no]23[/no]. [ocontrib][oauthor role="nd"][surname]Roldán[/surname], [fname]A[/fname][/oauthor]; [oauthor role="nd"][fname]JR[/fname] [surname]Salinas-García[/surname][/oauthor]; [oauthor role="nd"][fname]MM[/fname] [surname]Alguacil[/surname][/oauthor] & [oauthor role="nd"][fname]F[/fname] [surname]Caravaca[/surname][/oauthor]. [date dateiso="20050000" specyear="2005"]2005[/date]. [title language="en"]Changes in soil enzyme activity, fertility, aggregation and C sequestration mediated by conservation tillage practices and water regime in a maize field[/title][/ocontrib]. [oiserial][sertitle]Appl. Soil Ecol.[/sertitle][issueno]30[/issueno], [pages]11-20[/pages][/oiserial].[/ocitat]
[ocitat][no]24[/no]. [ocontrib][oauthor role="nd"][surname]Ruijter[/surname], [fname]JM[/fname][/oauthor]; [oauthor role="nd"][fname]S[/fname] [surname]Lefever[/surname][/oauthor]; [oauthor role="nd"][fname]J[/fname] [surname]Anckaert[/surname][/oauthor]; [oauthor role="nd"][fname]J[/fname] [surname]Hellemans[/surname][/oauthor]; [oauthor role="nd"][fname]MW[/fname] [surname]Pfaffl[/surname][/oauthor]; [oauthor role="nd"][fname]V[/fname] [surname]Benes[/surname][/oauthor]; [oauthor role="nd"][fname]SA[/fname] [surname]Bustin[/surname][/oauthor]; [oauthor role="nd"][fname]J[/fname] [surname]Vandesompele[/surname][/oauthor] & [oauthor role="nd"][fname]A[/fname] [surname]Untergasser[/surname][/oauthor]. [date dateiso="20150000" specyear="2015"]2015[/date]. [title language="en"]RDML-Ninja and RDMLdb for standardized exchange of qPCR data[/title][/ocontrib]. [oiserial][sertitle]BMC Bioinformatics[/sertitle] [issueno]16[/issueno], [pages]197[/pages][/oiserial].[/ocitat]
[ocitat][no]25[/no]. [ocontrib][oauthor role="nd"][surname]Salinas-Garcia[/surname], [fname]JR[/fname][/oauthor]; [oauthor role="nd"][fname]FM[/fname] [surname]Hons[/surname][/oauthor] & [oauthor role="nd"][fname]JE[/fname] [surname]Matocha[/surname][/oauthor]. [date dateiso="19970000" specyear="1997"]1997[/date]. [title language="en"]Longterm effects of tillage and fertilization on soil organic matter dynamics[/title][/ocontrib]. [oiserial][sertitle]Soil Sci. Soc. Am. J.[/sertitle] [issueno]61[/issueno], [pages]152-159[/pages][/oiserial].[/ocitat]
[ocitat][no]26[/no]. [ocontrib][oauthor role="nd"][surname]Sessitsch[/surname], [fname]A[/fname][/oauthor]; [oauthor role="nd"][fname]A[/fname] [surname]Weilharter[/surname][/oauthor]; [oauthor role="nd"][fname]MH[/fname] [surname]Gerzabek[/surname][/oauthor]; [oauthor role="nd"][fname]H[/fname] [surname]Kirchmann[/surname][/oauthor] &.[oauthor role="nd"][fname]E[/fname] [surname]Kandeler[/surname][/oauthor] [date dateiso="20010000" specyear="2001"]2001[/date]. [title language="en"]Microbial population structures in soil particle size fractions of a long-term fertilizer field experiment[/title][/ocontrib]. [oiserial][sertitle]Appl. Environ. Microbiol.[/sertitle][issueno]67[/issueno], [pages]4215- 4224[/pages][/oiserial].[/ocitat]
[ocitat][no]27[/no]. [ocontrib][oauthor role="nd"][surname]Six[/surname], [fname]J[/fname][/oauthor]; [oauthor role="nd"][fname]ET[/fname] [surname]Elliott[/surname][/oauthor] & [oauthor role="nd"][fname]K[/fname] [surname]Paustian[/surname][/oauthor]. [date dateiso="20000000" specyear="2000"]2000[/date]. [title language="en"]Soil macroaggregate turnover and microaggregate formation: a mechanism for C sequestration under no-tillage agriculture[/title][/ocontrib]. [oiserial][sertitle]Soil Biol. Biochem.[/sertitle][issueno]32[/issueno], [pages]2099-2103[/pages][/oiserial].[/ocitat]
[ocitat][no]28[/no].; [ocontrib][oauthor role="nd"][surname]Six[/surname], [fname]J[/fname][/oauthor] [oauthor role="nd"][fname]SD[/fname] [surname]Frey[/surname][/oauthor]; [oauthor role="nd"][fname]RK[/fname] [surname]Thiet[/surname][/oauthor] & [oauthor role="nd"][fname]KM[/fname] [surname]Batten[/surname][/oauthor]. [date dateiso="20060000" specyear="2006"]2006[/date]. [title language="en"]Bacterial and fungal contributions to carbon sequestration in agroecosystems[/title][/ocontrib]. [oiserial][sertitle]Soil Sci. Soc. Am. J.[/sertitle][issueno]70[/issueno], [pages]555-569[/pages][/oiserial].[/ocitat]
[ocitat][no]29[/no]. [ocontrib][oauthor role="nd"][surname]Stemmer[/surname], [fname]M[/fname][/oauthor]; [oauthor role="nd"][fname]MH[/fname] [surname]Gerzabek[/surname][/oauthor]&.[oauthor role="nd"][fname]E[/fname] [surname]Kandeler[/surname][/oauthor] [date dateiso="19980000" specyear="1998"]1998[/date].[title language="en"]Organic matter and enzyme activity in particle-size fractions of soils obtained after low-energy sonication[/title][/ocontrib]. [oiserial][sertitle]Soil Biol. Biochem.[/sertitle][issueno]30[/issueno], [pages]9-17[/pages][/oiserial].[/ocitat]
[ocitat][no]30[/no]. [ocontrib][oauthor role="nd"][surname]Tiemann[/surname], [fname]LK[/fname][/oauthor]; [oauthor role="nd"][fname]AS[/fname] [surname]Grandy[/surname][/oauthor]; [oauthor role="nd"][fname]EE[/fname] [surname]Atkinson[/surname][/oauthor]; [oauthor role="nd"][fname]E[/fname] [surname]Marin-Spiotta[/surname][/oauthor] & [oauthor role="nd"][fname]MD[/fname] [surname]McDaniel[/surname][/oauthor]. [date dateiso="20150000" specyear="2015"]2015[/date]. [title language="en"]Crop rotational diversity enhances belowground communities and functions in an agroecosystem[/title][/ocontrib]. [oiserial][sertitle]Ecol. Lett.[/sertitle] [issueno]18[/issueno], [pages]761-771[/pages][/oiserial].[/ocitat]
[ocitat][no]31[/no]. [ocontrib][oauthor role="nd"][surname]Tisdall[/surname], [fname]JM[/fname][/oauthor] & [oauthor role="nd"][fname]JM[/fname] [surname]Oades[/surname][/oauthor]. [date dateiso="19820000" specyear="1982"]1982[/date]. [title language="en"]Organic matter and waterstable aggregates in soils[/title][/ocontrib]. [oiserial][sertitle]Jou.Soil Sci.[/sertitle] [issueno]33[/issueno], [pages]141-163[/pages][/oiserial].[/ocitat]
[ocitat][no]32[/no]. [ocontrib][oauthor role="nd"][surname]Trivedi[/surname], [fname]P[/fname][/oauthor]; [oauthor role="nd"][fname]M[/fname] [surname]Delgado-Baquerizo[/surname][/oauthor]; [oauthor role="nd"][fname]TC[/fname] [surname]Jeffries[/surname][/oauthor]; [oauthor role="nd"][fname]C[/fname] [surname]Trivedi[/surname][/oauthor]; [oauthor role="nd"][fname]IC[/fname] [surname]Anderson[/surname][/oauthor]; [oauthor role="nd"][fname]M[/fname] [surname]McNee[/surname][/oauthor]; [oauthor role="nd"][fname]K[/fname] [surname]Flower[/surname][/oauthor]; [oauthor role="nd"][fname]B Pal[/fname] [surname]Singh[/surname][/oauthor]; [oauthor role="nd"][fname]D[/fname] [surname]Minkey[/surname][/oauthor] & [oauthor role="nd"][fname]BK[/fname] [surname]Singh[/surname][/oauthor]. [date dateiso="20170000" specyear="2017"]2017[/date]. [title language="en"]Soil aggregation and associated microbial communities modify the impact of agricultural management on carbon content[/title][/ocontrib]. [oiserial][sertitle]Environ. Microbiol.[/sertitle], [issueno]19[/issueno], [pages]3070-3086[/pages][/oiserial].[/ocitat]
[ocitat][no]33[/no]. [ocontrib][oauthor role="nd"][surname]Zabaloy[/surname], [fname]MC[/fname][/oauthor]; [oauthor role="nd"][fname]RM[/fname] [surname]Lehman[/surname][/oauthor]; [oauthor role="nd"][fname]SD[/fname] [surname]Frey[/surname][/oauthor]& [oauthor role="nd"][fname]JL[/fname] [surname]Garland[/surname][/oauthor]. [date dateiso="20080000" specyear="2008"]2008[/date]. [title language="en"]Optimization of an oxygen-based approach for communitylevel physiological profiling of soils[/title][/ocontrib]. [oiserial][sertitle]Soil Biol. Biochem.[/sertitle][issueno]40[/issueno], [pages]2960-2969[/pages][/oiserial][/ocitat]. [/other][/back][/article]