BIOLOGÍA DEL SUELO
Efectos de la labranza en la estructura y la actividad biológica a nivel de los microagregados del suelo
Effects of tillage systems on microbial structure and activity at microaggregate level
Juan Pablo Frene1, Luciano Andrés Gabbarini1, Luis Gabriel Wall1*
1. Universidad Nacional de Quilmes
*Autor de contacto: wall.luisgabriel@gmail.com
Recibido: 26/11/2017
Recibido con revisiones: 10/07/2018
Aceptado: 12/07/2018
RESUMEN
El conocimiento de la distribución de los microorganismos y la actividad enzimática en las fracciones de agregados
del suelo con manejo agrícola puede contribuir a comprender mejor los servicios ecosistémicos del suelo. El
objetivo de este trabajo fue evaluar el efecto de los sistemas de labranza (siembra directa y labranza convencional)
sobre la abundancia de microorganismos (hongos y bacterias) y la actividad biológica del suelo a nivel de
los microagregados del suelo. Los estudios se replicaron en suelos de dos sitios ambientalmente diferentes de la
región pampeana. Las muestras fueron tamizadas en húmedo, obteniéndose las siguientes fracciones de agregados:
2000-63, 63-20, 20-2 y 2-0,1 μm. La abundancia de bacterias y hongos fue medida por qPCR encontrándose
diferente abundancia según el tamaño de agregados. Los perfiles fisiológicos a nivel de comunidades se
diferenciaron según el tamaño de agregados independientemente del sistema de labranza y del sitio muestreado.
Por el contrario, a nivel de agregados los perfiles de actividad enzimática se agruparon principalmente por el
sistema de labranza y no por el tamaño de los mismos. Estos resultados nos permiten sugerir que la provisión de
servicios ecosistémicos del suelo es el resultado de una integración de la estructura física a nivel de agregados y
la actividad bioquímica propia de éstos.
Palabras claves: enzimas, clpp, manejos agricolas, fracciones de agregado de suelo
ABSTRACT
The knowledge of the distribution of microorganisms and the enzymatic activitiy at the level of soil fractions
aggregates would contribute to a better understanding of the ecosystemic services of the soil. The objective of
this work was to determine if two of the most relevant microbial groups, fungi and bacteria, and the biological
activity of the soil measured as a respiratory profile induced by substrates and / or the activity of extracellular
enzymes, were modified by differential tillage systems, and if that modification was reproduced at the microaggregate
level of the soil. Two agricultural farming practices were compared: no-tillage and conventional tillage.
The studies were replicated in soils of two different environmentally sites of the Pampean region. The samples
were wet sieved, obtaining the following fractions of aggregates: 2000-63, 63-20, 20-2 and 2-0.1 μm. The
abundance of bacteria and fungi was estimated by qPCR, finding different abundances according to the size of
the aggregates. The physiological profiles at the community level were differentiated according to the aggregates
size independently of the tillage management and the sampled site. On the contrary, at the level of aggregates,
the enzymatic profiles were differentiated more by soil tillage than by the size of the fraction. These results allow
us to suggest that soil ecosystemic services are the result of an integration of the physical structure at the level
of aggregates and their own biochemical activities.
Key words: enzymes, clpp, agriculture managements, soil aggregates fractions
INTRODUCCIÓN
Los diferentes manejos que se realizan en los
suelos bajo producción agrícola, modifican su estructura
biológica y por consiguiente, los servicios
ecosistémicos del suelo (Roldán et al., 2005).
La labranza convencional (LC) es un sistema de
laboreo donde los residuos de los cultivos son incorporados
al suelo por la acción del arado o la
rastra de discos. Este sistema de labranza se realiza
con la intención de introducir la materia orgánica,
remover malezas, airear el suelo, reducir la
compactación y controlar las plagas que afectan
a los cultivos con la finalidad de incrementar la
germinación de las semillas y el rendimiento de
los cultivos (Raper et al., 2000). Sin embargo,
también se sabe que la LC favorece la erosión
del suelo por pérdida de materia orgánica debido
a un aumento de los procesos de mineralización,
disminuye la infiltración del agua y genera
pérdida de la estructura física, disminuyendo la
calidad del suelo debido a la fragmentación de
los agregados del mismo (Allmaras et al., 2000).
En contraposición, la siembra directa (SD) es una
práctica de manejo utilizada con el fin de preservar
la estructura física e incrementar el carbono
(C) almacenado en el suelo, de este modo se proporciona
un hábitat y sustratos de mayor calidad
para la biota mejorando la biofertilidad del suelo
(Holland, 2004). En síntesis, diferentes sistemas
de labranza influyen diferencialmente sobre las
propiedades del suelo, incluyendo la distribución
de las fracciones de agregados del suelo y los sustratos
disponibles (Six et al., 2006; Tiemann et
al., 2015)
El proceso de agregación es un proceso dinámico,
en el cual los microagregados se unen
entre sí por medio de raíces, hongos, polímeros
orgánicos y residuos. A su vez, los microagregados
contribuyen a la formación de los macroagregados
(Tisdall & Oades, 1982, Lehmann et al.,
2017). Cada fracción de agregados constituye un
microambiente con características físicas, químicas
y estructurales únicas que influyen sobre las
comunidades microbianas que allí habitan (Mummey
et al., 2006).
Las comunidades microbianas del suelo tienen
un rol integral en prácticamente todos los servicios
ecosistémicos, incluyendo el ciclado de los
nutrientes y la descomposición de la materia orgánica
(Trivedi et al., 2017). La tasa con la cual
se llevan a cabo estos procesos está regulada
principalmente por aquellos microorganismos que
se encuentran presentes en las diferentes fracciones
de agregados (Davinic et al., 2012). Sin embargo,
poco se sabe sobre como los sistemas de
labranza influyen en las comunidades microbianas
y su funcionamiento a una escala de microagregados,
más propia de los microorganismos
(Ettema & Wardle, 2002). Conocer y comprender
la distribución de los microorganismos del suelo y
su actividad biológica a una escala menor quizás
permita comprender mejor los efectos de los diferentes
sistemas de labranza y sus efectos sobre
los servicios ecosistémicos y la productividad de
los suelos a largo plazo (Kandeler et al., 1999;
Salinas-Garcia et al., 1997)
El objetivo en este trabajo fue analizar el efecto
de sistemas de labranzas contrastantes en la distribución
cuali y cuantitativa de las comunidades
microbianas y su actividad bioquímica a nivel de
diferentes fracciones de tamaños de agregados.
Las hipótesis de trabajo son: i) la abundancia de
los microorganismos (hongos y bacterias) y las
respuestas bioquímicas son condicionadas por el
tamaño de la fracción de agregados, ii) el sistema
de labranza afecta la distribución de las fracciones
de agregados, y iii) que los manejos de labranza
no modifican la abundancia de los hongos
y bacterias ni las respuestas bioquímicas en las
diferentes fracciones de agregados.
MATERIALES Y MÉTODOS
Descripción de los sitios
Los suelos analizados corresponden a dos establecimientos
agrícolas de diferentes zonas de la
región pampeana. El primer caso corresponde a
un experimento de larga duración que se encuentra
en establecimiento Hogar Funke, localizado en
Tornquist (Provincia de Buenos Aires, Argentina;
38°09'S 61°57'O). El suelo es un Argiudol Típico
(264 mg kg-1 arcilla, 552 mg kg-1 limo, 184 mg
kg-1 arena), y es representativo de región pampeana
central-sudeste semiárida. La temperatura
anual promedio y las precipitaciones son 15
ºC y 800mm, respectivamente. Los sistemas de
labranza contrastantes, labranza convencional y siembra directa, fueron establecidos en 1986 en
dos parcelas de 8 ha. adyacentes. Los implementos
mecánicos utilizados en el sistema de labranza
convencional fueron cincel y rastra de disco con
una profundidad de 7-20 cm. En ambos manejos
agrícolas, la rotación de cultivos y aplicación de
agroquímicos fue similar, siendo de este modo la
única diferencia entre ambas parcelas el manejo
de labranza. Los suelos de Tornquist con SD tuvieron
valores de 21,4 mg g-1 de COT y en la LC
de 18,6 mg g-1. Los valores de fosforo extraíble
en las muestras bajo SD fueron 66,13 mg kg-1 suelo y en la LC 56,67 mg kg-1 suelo. El pH en
ambos manejos agrícolas fue 6. El segundo sitio
de muestreo se ubicó en el establecimiento Las
Matreras, localizado en Irineo Portela (Provincia
de Buenos Aires; 33º58'S 59º40'O). El ensayo
de SD tiene 15 años de historia y se maneja con
una rotación de cultivos típica para la zona, trigo/
soja-maíz-soja. El campo bajo LC corresponde
a un establecimiento vecino a Las Matreras que
se venía trabajando con este sistema de labranza
al momento del muestreo y sobre el cual no tenemos
mayor información de su historia de uso.
El caso de estudio en Irineo Portela se incluyó
para corroborar si los resultados obtenidos a nivel
de microagregados en el ensayo controlado y de
larga duración de Tornquist eran observables en
otro ambiente edafo-climático con manejo de labranzas
similares. Los casos de suelos analizados
en la zona de Irineo Portela corresponden a un
Argiudol Típico (261 mg kg-1 arcilla, 568 mg kg-1 lime, 171 mg kg-1 arena), del tipo franco arcilloso
limoso. El suelo de la zona constituye una unidad
fisiográfica (Pampa ondulada) caracterizada por
un relieve predominantemente ondulado y recortado
en parte por cañadas, arroyos y ríos, donde
sobresalen una serie de elevaciones divisorias de
aguas, interfluvios y áreas de nacientes. La temperatura
anual promedio y las precipitaciones
fueron 17ºC y 1070 mm, respectivamente. Los
suelos de ambos sistemas de labranza presentaron
valores de 42,4 mg g-1 de COT, 66,8 mg kg-1 de fosforo extractable y un pH de 5,8.
Las muestras fueron recolectadas de los primeros
cinco centímetros de suelo (0-5 cm) en
julio de 2014 para las muestras de Tornquist y
en mayo de 2015 para las muestras de Irineo
Pórtela. En cada tratamiento se tomaron cinco
muestras separadas por al menos 50 metros.
Para cada una de las muestras, se tomaron 25
piques de barreno (2 cm de diámetro) en un área
de 5 m2, que se mezclaron para generar la muestra
compuesta. Posteriormente, las muestras fueron
transportadas con geles refrigerantes y una
vez en el laboratorio una parte de cada muestra
se almacenó a 4ºC para su fraccionamiento y determinaciones
bioquímicas dentro de los dos primeros
meses posteriores al muestreo. Otra parte
equivalente fue secada a 40ºC, para las determinaciones
químicas.
Fraccionamiento del suelo
Para la separación de las fracciones de micro
agregados de diferentes tamaños del suelo se realizó
el procedimiento descripto por Stemmer et
al.(1998) y modificado posteriormente por Neumann
et al. (2013). El suelo se separó en cuatro
fracciones de agregados (2000-63, 63-20, 20-
2, 2-0,1 μm). Para ello, se tomó una cantidad
de suelo conservado a 4ºC equivalente a una
masa de 20 g de peso seco que se suspendió
en agua desionizada (suelo/agua: 1:5 p/v) y se
trató con ultrasonido con una energía de 30 J/mL
("UltrasonicCleaner",Testlab S.R.L., Argentina).
La fracción de 2000-63 μm (arena) fue separada
del resto de las fracciones por medio del tamizado
de la suspensión de suelo a través de una malla
de 63 μm. El líquido filtrado por la malla, que
arrastra todas las partículas menores a 63 μm fue
centrifugado a 50 g durante 15 min a 4ºC (Centrifuga
Refrigerada Multi-RF; Thermo Fischer Scientific,
EEUU). Para separar la fracción de 2-0,1
μm (arcillas) de la fracción 63-2 μm (limosa), el
sobrenadante de la centrifugación conteniendo la
fracción 2-0,1 μm fue conservado en un vaso de
precipitado y el precipitado fue re-suspendido en
agua desionizada y vuelto a centrifugar. La centrifugación
y resuspensión del precipitado se repitió
ocho veces más, con tiempos de centrifugación
decrecientes, 15, 13, 12 y 11 min por duplicado
cada uno de ellos, respectivamente. Posterior a la
última centrifugación, el precipitado fue tamizado
en húmedo con un tamiz con malla de 20 μm,
separando así la fracción de agregados 20-2 μm
(limosa fina) que atraviesa el tamiz, de la fracción 63-20 μm (limosa gruesa) que queda retenida.
Para aumentar la floculación de las partículas
menores a 2 μm, se agregó Cloruro de Magnesio
(MgCl2), con una concentración final de 3,3
mM, al contenido de los vasos de precipitados
donde se recogieron todos los sobrenadantes de
los procesos de resuspensión-centrifugación y se
incubaron a 4ºC durante 16 h. Posteriormente,
las partículas < 2 μm fueron concentradas por
centrifugación durante 10 min a 2400 g. Todas
las fracciones se secaron a 40ºC y luego se determinaron
las fracciones de los agregados por pesada.
Finalmente, las muestras se almacenaron a
4º C en heladera hasta su uso.
Extracción de ADN
EL ADN microbiano del suelo sin fraccionar
y de las fracciones de agregados fue extraído y
purificado a partir de 0,25 g de las muestras
utilizando el kit de extracción ZR Soil Microbe
DNA MiniPrep ™ (Zymo Research Corporation,
EEUU) de acuerdo al protocolo del fabricante.
La cantidad y la calidad de ADN extraído se
determinó por medio de un espectrofotómetro
Nano Drop ND-1000 spectrophotometer (Thermo
Fischer Scientific, EEUU), determinando
las relaciones de absorbancia 260/280 nm y
230/260 nm.
Cuantificación de los grupos microbianos
principales por qPCR
La abundancia de las copias de la subunidad
pequeña de gen ribosomal del ARN de bacterias
y hongos fueron cuantificados usando el protocolo
y los oligonucleótidos descripto por Fierer
et al., (2005). Para hongos, el oligonucleótido
usado fue 5.8s (5'-CGTTGCGTTCTTCATCG-3')
combinado con el oligonucleótido ITS1f (5'-TCCGTAGGTGAACCTGCGG-
3'), mientras que para
bacterias se usaron los oligonucleótidos Eub338
(5'-ACTCCTACGGGAGGCAGCAG-3') y Eub518
(5'-ATTACCGCGGCTGCTGG-3'). Para estimar la
abundancia se generaron curvas patrón usando
diluciones seriadas a partir de una concentración
conocida de ADN extraído de Pseudomonaprotegens
CHAØ o de Fusarium oxysporumpara bacterias
y hongos, respectivamente. El volumen final
de la reacción de real time-PCR fue 25 μl-12,5 μl
de Master MixqPCR SYBR (PB-L, Argentina),3μl
dedeoxi-nucleótidos,0,75 μl de cada oligonucleótido
iniciador (10 μM), y 7μl de agua estéril libre
de ADN-. En cada reacción se agregó1μl de
las muestras de ADN de suelo o el ADN utilizado
como curva de calibración. La reacción fue llevada
a cabo en un ciclador Smart Cycler (Cepheid,
EEUU) usando el programa: 94°C durante 15 min
seguido por 40 ciclos de 30 s a 94° C, 30 s a 50°
C y 30 s a 72°C; se utilizó la misma temperatura
de hibridación para hongos y bacterias. Se llevaron
a cabo curvas de hibridación y geles electroforéticos
para confirmar que los productos amplificados
fuesen del tamaño adecuado. El número
de copias de cada gen bacteriano o fúngico fue
generado usando una ecuación de regresión para
cada ensayo relacionando el valor del ciclo umbral
(Ct) para conocer el número de copias en los
patrones con una concentración conocida de ADN
por medio del programa Lin-RegPCR (Ruijter et
al., 2015). Todas las reacciones de qPCR fueron
corridas por triplicados para cada ADN extraído
de las muestras de suelo con el fin de obtener un
valor promedio.
Análisis de la actividad de enzimas
extracelulares (EAA)
El análisis de la actividad potencial de enzimas
hidrolíticas se realizó mediante ensayos en
placas de 96 celdas o pocillos, por fluorescencia
(Marx et al., 2001) en suelo sin fraccionar
y en distintas fracciones de microagregados. Las
muestras de suelo fueron ensayadas como fuente
de enzimas para las siguientes actividades enzimáticas:
β-cellobiohidrolasa (CEL), N-acetil-β-
glucosaminidasa (NAG), β-glucosidasa (BG), fosfatasa
(PME), y arilsulfatasa (SUL).
La suspensión de suelo sin fraccionar y de
las fracciones de agregados analizadas se realizó
agregando 0,1 g de suelo a un tubo de 20 ml
(BMT-20 S, IKA, Alemania) junto con 10 esferas
de acero de 5 mm de diámetro en 10 ml de buffer
MES (ácido etanolsulfónico2-[N-Morfolino];
Sigma, E.E.U.U.) estéril 0,1M y pH 6,1. La suspensión
se homogenizó con la ayuda del ULTRA
TURRAX®Tube Drive (IKA, Alemania) que agitó
las esferas de acero durante dos minutos a 6000 rpm y temperatura ambiente. La suspensión de
suelo generada fue inmediatamente utilizada para
medir las cinéticas enzimáticas.
Para realizar el ensayo se descargaron 200
ml de suspensión de suelo por pocillo con micropipeta
automática de 8 canales en una placa
de 96 pocillos. La turbidez propia del suelo y
los compuestos fenólicos que contiene disminuyen
en cierto grado la intensidad de la fluorescencia
del fluorósforo 4-metilumbelliferona
(4-MUB;Marx et al., 2001). El grado en que se
apaga esta señal varía para los diferentes suelos
por lo tanto se realizó una corrección para
cada suelo (muestra + 4-MUB). Además, en
cada placa se incluyó la mezcla de reacción de
la muestra por triplicado para cada una de las
concentraciones de sustrato (muestra + sustrato),
un control de sustrato (sustrato + buffer)
y un control de muestra (muestra + buffer). El
volumen final de la mezcla de reacción en cada
pocillo fue de 250 ml. La fluorescencia de los
controles se restó al valor de las muestras. Como
estándar se utilizó 4-MUB en concentración final
de 2 μM en el pocillo. Los sustratos 4-MUB-Fosfato,
4-MUB-β-D-cellobiosa, 4-MUB-N-acetil-
β-D-glucosamina, 4-MUB-β-D-glucopiranosa, y
4-MUB-sulfato (Sigma, E.E.U.U.) se disolvieron
en agua estéril y las concentraciones finales en
los pocillos fueron de 40μM.
La intensidad de la fluorescencia se leyó a
355 nm ya 460 nm de longitud de onda de excitación
y de emisión, respectivamente, en el
lector de fluorescencia para placas (POLARstar
Omega, BMG LABTECH, Alemania). El lector fue
programado para realizar 25 ciclos de lectura de
60 seg a 30 ºC. Las actividades enzimáticas se
calcularon como la cantidad de sustrato hidrolizado
por unidad de tiempo y se expresó en nmol
de 4-MUB producidos por hora y por gramo de
suelo seco.
Análisis de los Perfiles Fisiológicos a Nivel de
las Comunidades (CLPP) de suelo.
Para este ensayo se utilizaron unas placas
de 96 pocillos previamente preparadas con un
sistema biosensor de oxígeno para los análisis
fisiológicos de suelo (Garland et al., 2003) que
diseñamos y construimos de acuerdo al trabajo
de McLamore et al. (2014). Las suspensiones de
suelo fueron preparadas mezclando 1 g de suelo
con 5 ml de agua destilada estéril en un tubo
de 15 ml conteniendo aproximadamente 5 ml de
perlitas de metal de 2 mm para mezclado y homogenizado
mediante ULTRA TURRAX Tube Drive
(IKA, Alemania) durante 20 min. Las fuentes
de C seleccionadas fueron el ácido p-cumárico,
ácido propiónico y ácido vaníllico (Sigma-Aldrich
Co. Ltd.). Las fuentes de carbono utilizadas como
sustrato se eligieron de acuerdo a trabajos previos
(Zabaloy, 2008, Frene et al., 2014) siendo estos
los sustratos que mayor diversidad de respuestas
mostraron entre tratamientos, probablemente por
constituir fuentes de carbono cuya degradación
implica rutas metabólicas particulares, resaltando
las diferenciaciones de respuesta a nivel de
comunidades microbianas complejas. Las soluciones
madre de fuente de C (300 mg L-1) fueron
preparadas para obtener una concentración final
en el pocillo de 50 mg L-1de C. Todas las soluciones
stocks y el agua destilada fueron esterilizadas
utilizando filtros (<0,22 μm, Sartor, EEUU) y almacenados
a 4º C previos a ser ensayadas en las
microplacas.
En cada pocillo se agregaron 40 μl de las soluciones
de las fuentes de C o agua desionizada
estéril para determinar la respiración inducida
por sustrato o la respiración basal, respectivamente.
En cada pocillo, se agregaron160 μl de
las suspensiones de suelo con la adición 40 μl
de agua desionizada estéril hasta un volumen final
de 240 μl.
Los datos de las cinéticas de fluorescencia
de los consumos de oxigeno fueron expresados
como unidades de fluorescencia relativa normalizados
(UFRN).Los valores de UFRN se obtuvieron
dividiendo el valor de fluorescencia en
cada punto por el valor de fluorescencia medido
una hora después de haber comenzado el
ensayo. El tiempo mínimo de respuesta (TMR)
fue definido como el tiempo necesario para alcanzar
un valor de 1,1 de UFRN. El pico de
la respuesta fluorescente (Fmax) fue calculado
para todas las muestras como otro parámetro
de la actividad respiratoria, asumiendo una
tasa de difusión constante.
Análisis Estadístico
Las medias de los parámetros calculados para
los tratamientos y las fracciones de agregados del
suelo fueron analizadas por medio del test Análisis
de la Varianza ANOVA, previa corroboración
de los supuestos de normalidad y heterocedasticidad.
Las comparaciones de medias se realizaron
con el LSD de Fisher (P < 0,05). Los datos
experimentales fueron analizados y visualizados
utilizando un análisis multivariado de coordenadas
principales (ACoP), ya que este posibilita
cuantificar la distancias euclideas entre las
muestras. Todos los análisis estadísticos fueron
realizados con el software INFOSTAT (Di Rienzo
et al., 2013).
RESULTADOS
Distribución de las fracciones de agregados
Los suelos de Tornquist presentaron la mayor
proporción de agregados en la fracción 2000-63
μm (Figura 1), siendo significativamente mayor
en las muestras de SD que en las muestras de LC
(P = 0,019), seguido por la fracción 63-20 μm,
donde las muestras de la LC presentaron valores
significativamente mayores que las muestras de
SD (P = 0,028). Las fracciones 20-2 μm y 2-0,1
μm no presentaron diferencias significativas entre
los sistemas de labranza.
En los suelos de Irineo Pórtela (Figura 1), en
las fracciones 2000-63 μm y 63-20 μm no se
presentaron diferencias significativas entre los
sistemas de labranza, siendo la fracción 63-20
μm la que presentó la mayor proporción en ambos
casos. En la fracción 20-2 μm, las muestras
de la LC mostraron valores mayores que la SD
(P = 0,025). Por último, la fracción 2-0,1 μm
no presentó diferencias significativas entre tratamientos.

Figura 1. Proporción de cada fracción de tamaño de agregados, 200-63 mm, 63-20 mm,
20-2 mm, 2-0,1 mm, sobre el total de suelo recuperado en el fraccionamiento de suelo de
Tornquist y de Irineo Portela.
Figure 1. Amount of each aggregates size fraction, 200-63 mm, 63-20 mm, 20-2 mm,
2-0,1 mm, and total sum of aggregate fractions from soil samples of Tornquist and
Irineo Portela.
Análisis de las actividades biológicas
de los suelos sin fraccionar
En una primera etapa se analizaron los perfiles
de enzimas y CLPP de los suelos sin fraccionar
(SSF) buscando diferencias de acuerdo al sistema
de labranza (Figura 2). En el Análisis de Coordenadas
Principales (ACoP) de los perfiles enzimáticos para los suelos de Tornquist las muestras se
separaron por sistema de labranza (Figura 2A).
De forma similar, el ACoP basado en los datos del
CLPP también diferenció los suelos de Tornquist
de acuerdo al sistema de labranza (Figura 2B).
En el ACoP basado en el perfil enzimático de
las muestras de Irineo Pórtela (Figura 2C) las
muestras también se agruparon por sistema de
labranza y lo mismo ocurre cuando se analizó el
ACoP basado en los datos de CLPP de esos suelos
(Figura 2D).

Figura 2. Análisis de Coordenadas Principales (ACoP) de las muestras de suelo sin fraccionar
basados en a) perfil enzimático para Tornquist, b) CLPP para Tornquist, c) perfil enzimático para
Pórtela y d) CLPP para Irineo Portela (n=3).
Figure 2. Principal Coordinate Analysis (PCoA) from bulk soil samples based on for a) enzymatic
profile for Tornquist, b) CLPP for Tornquist, c) enzymatic profile for Irineo Portela, and d) CLPP
for Irineo Portela (n = 3).
Abundancia de hongos y bacterias
a nivel de microagregados
En las muestras de Tornquist, no hubo diferencias
significativas entre fracciones ni entre tratamientos
para las abundancias de los microorganismos
medidos (Tabla 1).
En las muestras de Irineo Pórtela, SD presentó
mayor abundancia bacteriana en las fracciones
2000-63, 63-20 y 2-0,1 μm (P = 0.015, P =
0.0149, P = 0.0001 respectivamente) respecto a LC. Bajo LC los mayores valores de abundancia
bacteriana se encontraron en la fracción 20-2 μm
(Tabla 1).
Tabla 1. Abundancia de bacterias y hongos (n = 5). Los valores con idéntica letra no se diferencian significativamente (P< 0,05). Las
letras mayúsculas representan las diferencias entre fracciones de tamaños agregados dentro de cada tratamiento y letras minúsculas
entre tratamientos para cada sitio y fracción de agregados.
Table 1. Bacteria and fungi abundance (n = 5). The values with identical letters do not differ significantly (P <0.05). Capital letter
represents differences within soil aggregate size fractions and the lowercase between treatments for site and soil aggregate fractions.
SD = Siembra directa; LC = Labranza convencional; SSF = % de recuperación del fraccionamiento respecto del suelo sin fraccionar.
SD = No-tillage; LC = Conventional tillage; SSF = % of bulk soil recovery after fractionation.

LC = labranza convencional; SD = siembra directa.
LC = conventional tillage; SD = No-tillage
La abundancia de los hongos no presentó diferencias
significativas entre tratamientos ni fracciones
en ninguno de los dos sitios.
Actividades enzimáticas a nivel de
microagregados.
En las muestras de Tornquist en SD, las actividades
de la enzimas β-glucosidasa (BG) fueron
mayores tanto en la fracción de 2000-63
mm como la de 63-20 mm respecto a las de
20-2 mm y 2-0.1 mm. La actividad de N-acetil-
β-glucosaminidasa (NAG) fueron mayores en la
fracción 2000-63 μm respecto a las actividades
en las fracciones 20-2 (Figura 3). Estas enzimas
presentaron una disminución de su actividad específica
desde la fracción 2000-63 μm hasta la
fracción 20-2μm. La actividad de fosfatasa (PME)
no mostró diferencias significativas relevantes entre
fracciones, salvo para la fracción 2-0.1 mm
que tuvo valores significativamente menores respecto
a las otras fracciones. La actividad de la
β-cellobiohidrolasa (CEL) y la arilsulfatasa (SUL)
presentaron las mayores actividades en la fracción 2-0,1 μm. Por otro lado, en las muestras de
Tornquist en LC, la actividad de la enzima BG fue
mayor en la fracción 2000-63 μm en relación a
la fracción 2-0.1 μm y disminuyendo su valor con
el tamaño de la fracción. Las actividades de NAG
y PME no mostraron diferencias significativas relevantes
entre fracciones en general salvo para el
caso de NAG cuya actividad en la fracción 63-20
μm fue significativamente menor que la de 2-0,1
μm; la actividad de CEL y SUL resultó superior en
la fracción 2-0,1 μm. Cuando se compara entre
sistemas de labranza para el sitio de Tornquist
solo se encontraron diferencias significativas, con
valores mayores en SD que en LC, para la actividad
BG en la fracción 2000-63 μm (P = 0,047) y la actividad SUL en la fracción 2-0,1 μm (P =
0,028).

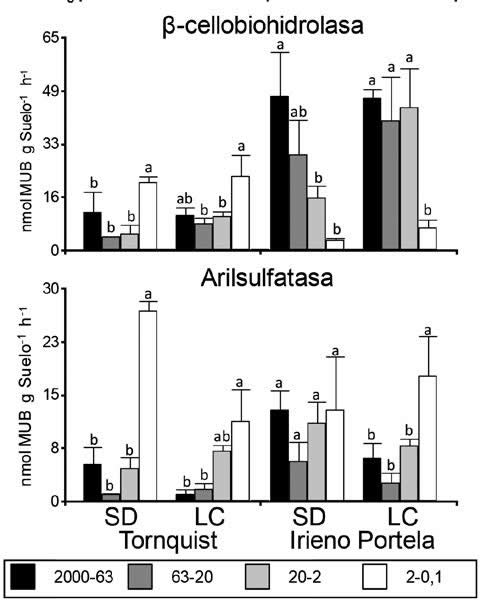
SD = Siembre directa; LC = labranza convencional.
SD = No-tillage; LC = conventional tillage.
Figura 3. Actividad enzimática para cada fracción de tamaño de agregados del suelo y sitio. Las barras de error representan el error
estándar y las letras marcan diferencias significativas (P<0.05) entre las fracciones de agregados para cada tratamiento y sitio(n = 5).
Figure 3. Enzymatic activity for each soil aggregate fractions and site. Error bars represented standard error and letters point
differences between soil aggregates fractions for each treatment and site(n=5).
En las muestras de Irineo Portela (Figura 3)
se verifica una mayor actividad enzimática general
respecto de las actividades de los suelos de
Tornquist (P< 0,0001 para todas las actividades
enzimáticas con excepción de SUL donde no
hubo diferencias significativas). En comparación
al resto de las fracciones en el mismo suelo, las
muestras presentaron mayor actividad para las
cinco enzimas en la fracción 2000-63 μm en SD
y las actividades de BG, NAG y CEL disminuyeron
con el tamaño de fracción. En las muestras en
LC, la actividad de PME fue mayor en la fracción
20-2 μm respecto al resto de las fracciones, y la actividad de la CEL fue alta y similar en las tres
fracciones de mayor tamaño. Finalmente, la SUL
mostró la mayor actividad en la fracción 2-0,1
μm. No se presentaron diferencias significativas
en la actividad enzimática entre los sistemas de
labranza en ninguna fracción de agregados.
En el análisis multivariado ACoP del perfil enzimático
de las fracciones de agregados provenientes
de ambos sistemas de labranza para los
suelos de Tornquist (Figura 4A), encontramos que
las muestras de mayor tamaño, 2000-63 μm y
63-20 μm tienden a agruparse por sistema de
labranza mientras que las de menor tamaño 20-2
y 2-0,1 μm tienden a agruparse por tamaño de
fracción.
En el ACoP del perfil enzimático de las fracciones
de agregados provenientes de Irineo Portela
(Figura 4B) las muestras presentaron menor separación
de acuerdo al sistema de labranza que
lo observado en las muestras de Tornquist (Figura
4A). Las fracciones de agregados de 63-20 μm y
2000-63 μm se ubicaron cercanas entre sí, mientras
que ambas fracciones de 2-0,1 μm se separaron
del resto de las fracciones de agregados en
cercanía con la fracción 20-2 μm perteneciente a
la SD (Figura 4B).

LC = labranza convencional; SD = siembra directa.
LC = conventional tillage; SD = No-tillage
Figura 4. Análisis de Coordenadas Principales del perfil enzimático de las muestras de las fracciones de agregados para A)
Tornquist, B) Irineo Pórtela (n=10).
Figure 4. Principal Coordinate Analysis of the enzymatic profile from soil aggregates fraction samples for A) Tornquist, B)
Irineo Portela (n = 10).
Análisis de los perfiles fisiológicos (CLPP) a
nivel de microagregados.
El análisis multivariado ACoP, de los perfiles
fisiológicos de las diferentes fracciones arrojó un
resultado diferente a lo observado para los perfiles
enzimáticos (Figura 5). En el caso de Tornquist
(Figura 5A), las muestras tienden a agruparse
por tamaño de fracción más que por el sistema
de labranza. Las fracciones de agregados 2000-
63 μm y 63-20 μm presentaron las menores distancias
entre sistema de labranza. Por otro lado,
ambas fracciones de 2-0,1 μm se separaron del
resto de las fracciones de agregados.

LC = labranza convencional; SD = siembra directa.
LC = conventional tillage; SD = No-tillage.
CLPP = Perfil fisiológico a nivel de comunidades microbianas;
CLPP= Microbial community level physiological profile
Figura 5. Análisis de Coordenadas Principales para el CLPP de las muestras de las fracciones de agregados para a) Tornquist y b)
Irineo Pórtela (n=10).
Figure 5. Principal Coordinate Analysis of CLPP from soil aggregates fraction samples for A) Tornquist, B) Irineo Portela (n = 10).
En el ACoP de las muestras de suelo de Irineo
Portela (Figura 5B), las muestras se agruparon de
acuerdo al tamaño de fracción principalmente, y
solo se separa del resto la fracción de 2-0,1 μm
perteneciente a la LC.
DISCUSIÓN
Las comunidades microbianas determinan en
gran medida la actividad bioquímica de los suelos.
El mecanismo primario por el que los sistemas
de labranzas influyen sobre las comunidades
microbianas del suelo es a través de la transformación
de la estructura del suelo y la disponibilidad
de substratos (Elliott & Coleman, 1988).
Los datos obtenidos en este trabajo en un primer
análisis del suelo sin fraccionar muestran que dos
sistemas de labranza contrastantes modifican en
forma diferencial el perfil bioquímico del suelo
como han sugerido otros autores (Kandeler et al.,
1999). Esta observación se verifica tanto a nivel
de actividad de enzimas del suelo como de perfiles
fisiológicos a nivel de comunidades microbianas.
A partir de esta diferencia surgió la pregunta
sobre lo que sucede a nivel de los microagregados
de diferente tamaño, resistentes al tamizado en
húmedo de los suelos, para profundizar en el conocimiento
de la relación estructura y función de
los suelos.
El conocimiento de las comunidades microbianas
dentro de cada microambiente (fracciones
de agregados) es de interés científico para poder
comprender mejor los mecanismos que conducen
los procesos de ciclado de los nutrientes en
el suelo, los cuales tienen importantes implicaciones
en la provisión de servicios ecosistémicos
(Grundmann et al., 2004). La determinación de
la abundancia relativa de hongos y bacterias por
qPCR a partir de las fracciones de agregados de
diferentes tamaños mostró algunas diferencias
dependiendo del tamaño del agregado y del sitio o
tipo de suelo. En Tornquist no se encontraron diferencias
en las abundancias. En el suelo de Irineo Portela los agregados de 2000-63 mm mostraron
diferencias en la abundancia de bacterias respecto
del sistema de labranza, con mayor abundancia
en los agregados provenientes del suelo en SD
y este comportamiento se extendió a la fracción
63-20 mm (Tabla 1). Un reciente análisis de metadatos
sugiere la importancia de las bacterias en
la agregación de microagregados mientras que los
hongos tendrían una mayor participación en la estabilidad
de los macroagregados (Lehmann et al.,
2017). Este tipo de resultado ha sido explicado
como la consecuencia de una mayor protección
física para los microorganismos en este tamaño
de fracción (Lagomarsino et al., 2012; Sessitsch
et al., 2001) donde se encuentran los mayores
niveles de C (Neumann et al., 2013). De todos
modos es importante recordar que abundancias
equivalentes de los grupos microbiológico pueden
contener una estructura diferente en la diversidad
microbiológica que resulte en distintas capacidades
fisiológicas. Si bien en este trabajo no hemos
analizado la diversidad de la estructura microbiológica
de bacterias u hongos, las determinaciones
de comportamientos diferenciales de los CLPP en
los suelos con diferentes labranzas sugieren que
las comunidades microbiológicas son diferentes.
A nivel de los agregados, en el caso de Tornquist,
el análisis de los CLPP evidenció una agrupación
de las muestras por tamaño de agregados,
más que por sistema de labranza del suelo, lo que
sugiere una comunidad microbiana de características
semejantes de acuerdo al tamaño del agregado
que sería independiente de ambos sistemas
de labranza (SD y LC).
El patrón general de las actividades enzimáticas
estaría gobernado por la cantidad y calidad
de los sustratos orgánicos (Deng & Tabatabai,
1996). Las diferentes enzimas se encuentran
asociadas de manera diferencial con las arcillas o
con los residuos de las plantas, dependiendo del
mecanismo de estabilización físico-químico y las
disponibilidades de los sustratos (Lagomarsino et
al., 2012; Allison & Jastrow, 2006; Kandeler et
al., 1999). En este trabajo observamos una distribución
de las actividades enzimáticas específicas
de acuerdo al sistema de labranza a nivel de las
diferentes fracciones de microagregados del suelo
(Figura 3). En los suelos bajo SD las actividades
de las enzimas BG, NAG fueron mayores en las
fracciones más grandes de 2000-63 mm y en algunos
casos también 63-20 mm y la actividad
disminuyó desde las fracciones más grandes a las
de menor tamaño, principalmente en los suelos
de Irineo Pórtela. Estas diferencias no se observan
en las muestras de los suelos bajo LC. Para
el caso de SD se ha demostrado que el C orgánico
(fresco o lábil) derivado de los residuos de los
cultivos es primero incorporado en las fracciones
de mayor tamaño (2000-200 μm) durante la descomposición
inicial y luego acumulado en las de
menor tamaño (Six et al., 2000; Stemmer et al.,
1998) Consecuentemente, esto se traduce en un
mayor contenido de C y N lábil en las fracciones
de mayor tamaño, lo que estimularía una mayor
producción de enzimas extracelulares (Qin et al.,
2010), resultados que se verifica en las fracciones
de 2000-63 μm y 63-20 μm para las enzimas
β-glucosidasa y N-acetil-glucosaminidasa
(Figura 3) de los ciclos de C y N respectivamente.
En concordancia con nuestras observaciones
para la enzima β-glucosidasa, Allison & Jastrow
(2006) observaron que la mayor actividad de las
enzimas relacionadas con el C y P, también analizadas
en este trabajo, se encuentran favorecidas
en las fracciones mayores a 250 μm, sugiriendo
que los microorganismos aquí presentes producen
mayores cantidades de enzimas hidrolíticas,
con el fin de degradar los materiales derivados de
las plantas presentes en mayor abundancia en las
fracciones de mayor tamaño en la SD (Marx et
al., 2005). La falta de concordancia con las actividades
de fosfatasas en nuestros resultados, que
no mostraron una mayor actividad en los agregados
de mayor tamaño, podría variar de acuerdo
a la disponibilidad de P en los diferentes suelos
que se comparan. En cambio, en las fracciones
de menor tamaño, el C se encontraría protegido
por las partículas minerales y consecuentemente
tendría una baja disponibilidad microbiana y eso
conduciría a una menor actividad enzimática en
esas fracciones (Qin et al., 2010). Por el contrario,
en el caso de LC, la perdida de la estructura
y el aumento de la mineralización del C, especialmente
en las fracciones de mayor tamaño que no
están protegidas por las arcillas, podría explicar
los menores valores enzimáticos encontrados en
algunas de las fracciones de mayor tamaño en los suelos de LC al contrario de lo que ocurre en las
mismas fracciones de SD.
En líneas generales nuestros resultados concuerdan
con lo publicado por Jiang y colaboradores
(2011), quienes mostraron que el tamaño
de agregados determina el patrón de distribución
de la actividad microbiana en el suelo, donde el
efecto de la labranza no fue significativo a escala
de los microagregados.
CONCLUSIONES
La comparación de suelos bajo diferentes sistemas
de labranza, siembra directa y labranza convencional,
muestra que el factor mecánico modifica
las propiedades bioquímicas del suelo generando
diferencias en los perfiles enzimáticos y en los perfiles
fisiológicos del mismo. La labranza también
modifica las proporciones de microagregados que
forman el suelo. Las diferencias bioquímicas por
labranza halladas en el suelo sin fraccionar no
se observan cuando las mismas son analizadas
a nivel de los microagregados. Esto implica que
las propiedades bioquímicas de los suelos y las
prestaciones ecosistémicas que derivan de ellas,
dependen de la proporción de microagregados que
generan los diferentes sistemas de labranza.
AGRADECIMIENTOS
Agradecemos a Cristian Klein y a Belén Agosti
por su participación en los muestreos. Este trabajo
fue financiado por el Ministerio de Ciencia,
Tecnología e Innovación Productiva de Argentina
(ANPCYT PAE 36976 y PID53) y la Universidad
Nacional de Quilmes (PUNQ R732/11). LA
Gabbarini y LG Wall son investigadores de CONICET
y JP Frene fue becario Doctoral CONICET
durante este trabajo.
BIBLIOGRAFIA
1. Allison, SD & JD Jastrow. 2006. Activities of extracellular
enzymes in physically isolated fractions of restored
grassland soils. Soil Biol. Biochem. 38, 3245–3256.
2. Allmaras, RR; HH Schomberg; CL Douglas & TH Dao. 2000.
Soil organic carbon sequestration potential of adopting
conservation tillage in US croplands. J. Soil Water Conserv.
55, 365–373.
3. Davinic, M; LM Fultz; V Acosta-Martinez; FJ Calderón; SB
Cox; SE Dowd; VG Allen; JC Zak & J Moore-Kucera.
2012. Pyrosequencing and mid-infrared spectroscopy
reveal distinct aggregate stratification of soil bacterial
communities and organic matter composition. Soil Biol.
Biochem. 46, 63–72.
4. Deng, SP & MA Tabatabai. 1996. Effect of tillage and residue
management on enzyme activities in soils. Biol.
Fertil. Soils 22, 202–207.
5. Di Rienzo JA, F Casanoves; MG Balzarini; L Gonzalez; M
Tablada & CW Robledo. 2013. InfoStat versión 2013.
Grupo InfoStat, n.d.
6. Elliott, ET & DC Coleman. 1988. Let the soil work for us.
Ecol. Bull. 23–32.
7. Ettema, CH & DA Wardle. 2002. Spatial soil ecology. Trends
Ecol. Evol. 17, 177–183.
8. Fierer, N; JA Jackson; R Vilgalys & RB Jackson. 2005. Assessment
of soil microbial community structure by use
of taxon-specific quantitative PCR assays.Appl. Environ.
Microbiol. 71, 4117–4120.
9. Frene, JP; LA Gabbarini & LG Wall. 2014. Perfil fisiológico
del suelo y discriminación de prácticas agrícolas. Congreso
Argentino de Ciencia del Suelo, Bahía Blanca, 5
al 9 de mayo.
10. Garland, JL; MS Roberts; LH Levine & AL Mills. 2003.
Community-level physiological profiling performed with
an oxyge-sensitive fluorophore in a microtiter plate. Appl.
Environ. Microbiol. 69, 2994–2998.
11. Grundmann, GL. 2004. Spatial scales of soil bacterial diversity
– the size of a clone. FEMS Micr. Ecol. 48, 119-127.
12. Holland, JM. 2004. The environmental consequences of
adopting conservation tillage in Europe: reviewing the
evidence. Agric. Ecosyst. Environ. 103, 1–25.
13. Jiang, X; AL Wright; J Wang & Z Li. 2011. Long-term tillage
effects on the distribution patterns of microbial biomass
and activities within soil aggregates. Catena 87,
276–280.
14. Kandeler, E; M Stemmer & EM Klimanek. 1999. Response
of soil microbial biomass, urease and xylanase within
particle size fractions to long-term soil management.
Soil Biol. Biochem. 31, 261–273.doi:10.1016/S0038-
0717(98)00115-1
15. Lagomarsino, A; S Grego & E Kandeler. 2012. Soil organic
carbon distribution drives microbial activity and functional
diversity in particle and aggregate-size fractions. Pedobiologia
55, 101–110.
16. Lehmann, A; W Zheng & MC Rillig. 2017. Soil biota contributions
to soil aggregation. Nature Ecology & Evolution
1, 1828–1835
17. Marx, MC; M Wood & SC Jarvis. 2001. A microplate fluorimetric
assay for the study of enzyme diversity in soils.
Soil Biol. Biochem. 33, 1633–1640.
18. McLamore, E; J Garland; C Mackowiak; A Desaunay; N Garland;
P Chaturvedi; M Taguchi K Dreaden; J Catechis &
J Ullman. 2014. Development and validation of an open
source O2-sensitive gel for physiological profiling of soil
microbial communities. J Microbiol Methods 96:62–67
19. Mummey, D; W Holben; J Six & P Stahl. 2006. Spatial stratification
of soil bacterial populations in aggregates of diverse
soils. Microb. Ecol. 51, 404–411.
20. Neumann, D; A Heuer; M Hemkemeyer; R Martens & CC
Tebbe. 2013. Response of microbial communities to
long-term fertilization depends on their microhabitat.
FEMS Microbiol. Ecol. 86, 71–84.
21. Qin, S; C Hu; X He; W Dong; J Cui & Y Wang. 2010.Soil organic
carbon, nutrients and relevant enzyme activities in particlesize
fractions under conservational versus traditional agricultural
management. Appl. Soil Ecol. 45, 152–159.
22. Raper, RL; DW Reeves; CH Burmester & EB Schwab. 2000.
Tillage depth, tillage timing, and cover crop effects on cotton
yield, soil strength, and tillage energy requirements.
Appl. Eng. Agric. 16, 379.
23. Roldán, A; JR Salinas-García; MM Alguacil & F Caravaca.
2005. Changes in soil enzyme activity, fertility, aggregation
and C sequestration mediated by conservation tillage
practices and water regime in a maize field. Appl. Soil
Ecol. 30, 11–20.
24. Ruijter, JM; S Lefever; J Anckaert; J Hellemans; MW Pfaffl;
V Benes; SA Bustin; J Vandesompele & A Untergasser.
2015. RDML-Ninja and RDMLdb for standardized exchange
of qPCR data. BMC Bioinformatics 16, 197.
25. Salinas-Garcia, JR; FM Hons & JE Matocha. 1997. Longterm
effects of tillage and fertilization on soil organic matter
dynamics. Soil Sci. Soc. Am. J. 61, 152–159.
26. Sessitsch, A; A Weilharter; MH Gerzabek; H Kirchmann
& E Kandeler. 2001. Microbial population structures
in soil particle size fractions of a long-term fertilizer
field experiment. Appl. Environ. Microbiol. 67, 4215–
4224.
27. Six, J; ET Elliott & K Paustian. 2000. Soil macroaggregate
turnover and microaggregate formation: a mechanism for
C sequestration under no-tillage agriculture. Soil Biol.
Biochem. 32, 2099–2103.
28. Six, J; SD Frey; RK Thiet & KM Batten. 2006. Bacterial and
fungal contributions to carbon sequestration in agroecosystems.
Soil Sci. Soc. Am. J. 70, 555–569.
29. Stemmer, M; MH Gerzabek & E Kandeler. 1998.Organic
matter and enzyme activity in particle-size fractions of
soils obtained after low-energy sonication. Soil Biol. Biochem.
30, 9–17.
30. Tiemann, LK; AS Grandy; EE Atkinson; E Marin-Spiotta &
MD McDaniel. 2015. Crop rotational diversity enhances
belowground communities and functions in an agroecosystem.
Ecol. Lett. 18, 761–771.
31. Tisdall, JM & JM Oades. 1982. Organic matter and waterstable
aggregates in soils. Jou.Soil Sci. 33, 141-163.
32. Trivedi, P; M Delgado-Baquerizo; TC Jeffries; C Trivedi; IC
Anderson; M McNee; K Flower; B Pal Singh; D Minkey
& BK Singh. 2017. Soil aggregation and associated microbial
communities modify the impact of agricultural
management on carbon content. Environ. Microbiol., 19,
3070-3086.
33. Zabaloy, MC; RM Lehman; SD Frey & JL Garland. 2008. Optimization
of an oxygen-based approach for communitylevel
physiological profiling of soils. Soil Biol. Biochem.
40, 2960–2969.






