* Autor de contacto: stourn@mdp.edu.ar
Recibido:
13-07-21
Recibido con revisiones: 06-12-21
Aceptado:
07-12-21

ACTIVIDAD MICROBIOLÓGICA GLOBAL COMO INDICADOR
DE SALUD EDÁFICA EN MOLISOLES DEL SUDESTE BONAERENSE
Santiago Néstor Tourn 1 *, Cecilia del Carmen Videla 1 2, Guillermo Alberto Studdert 1 2
1 Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata
2 Unidad Integrada Balcarce
RESUMEN
La actividad biológica del suelo (i.e. carbono (C) mineralizado (Cmin)) es clave para la evaluación de la salud edáfica. En el sudeste de Buenos Aires (SEB) existe poca información sobre cómo la intensificación ecológica de la agricultura (IEA) afecta la actividad biológica global del suelo y el C potencialmente mineralizable (C0) para mejorar la comprensión de los mecanismos de la dinámica del C edáfico. Es importante conocer cuál es la duración de incubación adecuada para estimar el C0 de suelos del SEB. Además, el Cmin en los primeros días de incubación sería una alternativa rápida para estimar el C0. Se hipotetizó que es necesario prolongar los periodos de incubación respecto a los propuestos en la literatura para evaluar el C0 en suelos del SEB y que el CO2 emitido durante períodos cortos de incubación es buen estimador del C0. Se tomaron muestras de suelo (0-5 y 5-20 cm) de un ensayo de larga duración sobre Molisoles en Balcarce, con diferentes niveles de IEA bajo labranza convencional y siembra directa (SD). Se determinó C orgánico total (COT), particulado (COP) y asociado y el Cmin en incubaciones aeróbicas bajo condiciones controladas a los 2, 4, 6, 10, 16, 22, 28 y 63 días. Se estimó el C0 a partir del Cmin determinado a los 22, 28 y 63 días. Los Cmin y el C0 mostraron patrones similares entre sistemas de cultivo. Las estimaciones de C0 a partir del Cmin a los 63 días fueron las más confiables (promedio de C0 de 466,9 y 517,8 mg C kg-1 a partir de Cmin(28) y de Cmin(63), respectivamente). Además, los Cmin a los pocos días de incubación mostraron coeficientes de correlación elevados (r entre 0,68 y 0,92 a 0-20 cm para 2 a 10 días de incubación) con C0 prometiendo ser buenos estimadores del C0.
Palabras claves: carbono potencialmente mineralizable; tiempo de incubación; sistemas de cultivo; rotaciones con pasturas.
GLOBAL MICROBIAL ACTIVITY AS SOIL HEALTH INDICATOR IN MOLLISOLS
OF THE SOUTHEASTERN BUENOS AIRES PROVINCE. METHOD ADJUSTMENTS
ABSTRACT
Soil biological activity (i.e. mineralized carbon (C) (Cmin)) is a crucial property to evaluate soil health and its changes due to soil use. In the southeastern Buenos Aires province (SEB) there is scarce information about how agriculture ecological intensification (IEA) affects soil global biological activity and the potentially mineralized C (C0) to improve the comprehension of the mechanisms that regulate soil C dynamics. It would be relevant to determine the adequate incubation time at which the determination of Cmin can predict C0 in soils from the SEB. Moreover, the Cmin determined in early incubation days has been proposed as a quick alternative to estimate C0. It has been hypothesized that it is necessary to run longer incubations to correctly evaluate C0 of soils of the SEB and that the CO2 emitted during short incubation periods is a good estimator of C0. Soil samples were taken (0-5 and 5-20 cm) from a long-term experiment on crop-pasture rotations on Mollisols at Balcarce with different levels of IEA under conventional tillage and no-tillage (SD). Total (COT), particulate (COP) and associated organic C were determined, as it was the Cmin from aerobic incubations under controlled conditions at 2, 4, 6, 10, 16, 22, 28, and 63 days. The C0 was estimated from the Cmin at 22, 28, and 63 days. The Cmin and C0 showed similar patterns among cropping systems. The estimations of C0 from the Cmin at 63 days were the most trustable (mean of C0 466,9 and 517,8 mg C kg-1 from Cmin(28) and Cmin(63), respectively). Furthermore, the Cmin at a few days of incubation showed high correlation coefficients with C0 (r between 0.68 and 0.92 at 0-20 cm for 2 to 10 incubation days) and therefore short incubations would be promising to estimate C0.
Keywords: potentially mineralizable carbon; time of incubation; cropping systems; crop-pasture rotations.
ABREVIATURAS
50LC: rotación 50% del tiempo (3 años) con agricultura bajo labranza convencional; 50SD: rotación 50% del tiempo (3 años) con agricultura bajo siembra directa; 75LC: rotación 75% del tiempo (9 años) con agricultura bajo labranza convencional y 25% bajo pastura (3 años); 75SD: rotación 75% del tiempo (9 años) con agricultura bajo siembra directa y 25% bajo pastura (3 años); 100LC: agricultura continua bajo labranza convencional; 100SD: agricultura continua bajo siembre directa; C: carbono; C0: carbono potencialmente mineralizable; Cmin: carbono mineralizado; Cmin(t): carbono mineralizado en el tiempo (t) de incubación; CO2: dióxido de carbono; COA: carbono orgánico asociado a la fracción mineral; COP: carbono orgánico particulado; COT: carbono orgánico total; IEA: intensificación ecológica de la agricultura; LC: labranza convencional; PP: pastura permanente; SD: siembra directa; SEB: Sudeste Bonaerense.
INTRODUCCIÓN
La búsqueda de prácticas de manejo que permitan lograr un suelo sano y funcional es sumamente necesaria para que se cumpla con los objetivos de los agroecosistemas sostenibles (Lal, 2019). Se considera que un suelo sano es aquel que conserva niveles altos de carbono (C) orgánico total (COT) (Lal, 2019). Además, altos niveles de COT están relacionados, entre otras cosas (i.e. biodiversidad y actividad biológica, disponibilidad y reciclo de nutrientes, contenido de fracciones orgánicas lábiles), con más cantidad y estabilidad de los agregados (Six et al., 2004; Tourn et al., 2019). El nivel de agregación del suelo (cantidad y estabilidad de agregados) juega un rol fundamental en la capacidad de secuestro de C y en su protección física (Balesdent et al., 2000). Por ello, es fundamental la elección de prácticas agrícolas que permitan aumentar o mantener los niveles de agregación y de COT en el suelo (Lal, 2019).
Existe evidencia de que las prácticas de manejo conservacionista basadas en la baja remoción del suelo, como la siembra directa (SD), incrementan la estabilidad estructural (Sheehy et al., 2015). Sin embargo, aquellas prácticas no siempre se traducen en aumentos netos de COT (Ogle et al., 2019; Studdert et al., 2017; Tourn et al., 2019). Así, puede no lograrse una recomposición de la salud del suelo si las prácticas con poca remoción del suelo no son complementadas con un aumento de la intensificación ecológica del uso del suelo (IEA) (Lal, 2019; Novelli et al., 2017). The IEA se refiere a mayor producción por unidad de recursos utilizados minimizando el impacto ambiental (Hochman et al., 2013) a través de, entre otras cosas, mayor cantidad de cultivos por unidad de tiempo (Novelli et al., 2017). Así, el aumento del tiempo con raíces vivas explorando el suelo, juntamente con la ausencia de laboreo, permite incrementar la actividad biológica del suelo, el COT y la cantidad y estabilización de los agregados (Franzluebbers et al., 2014; Studdert et al., 1997).
En el Sudeste Bonaerense (SEB) se ha reportado que la IEA debida a la inclusión de periodos cortos de pasturas en sistemas agrícolas provocó mejoras en los contenidos de COT, independientemente del sistema de labranza (Domínguez et al., 2016; Rivero et al., 2020; Tourn et al., 2019). Sin embargo, diversos autores locales informaron que la combinación de períodos cortos de pastura en la rotación y SD mejoró la estabilidad estructural en comparación con la labranza convencional (LC) (Rivero et al., 2020; Tourn et al., 2019). Para poder elegir y aplicar las prácticas de manejo adecuadas para cada situación, es necesario comprender los cambios que éstas generan sobre las propiedades que definen la salud del suelo y cuáles son los procesos involucrados (Lal, 2019). En el SEB el estudio de la salud del suelo se ha realizado mayormente a partir de la determinación de los contenidos de COT y sus fracciones lábiles y de la estabilidad de agregados (García et al., 2020; Studdert et al., 2017; Tourn et al., 2019). Sin embargo, existe muy poca información sobre cómo la IEA por inclusión de períodos bajo pastura y con diferentes sistemas de labranza, afecta la actividad biológica global del suelo y su potencial de mineralización.
La actividad biológica del suelo y su papel en la mineralización de C son componentes clave para la evaluación de la salud del suelo y los cambios en su uso (Franzluebbers, 2020). El conocimiento de la mineralización de C permite comprender los mecanismos que gobiernan los cambios en respuesta a diferentes manejos y cómo éstos pueden estimular o perjudicar al secuestro de C en el suelo (Franzluebbers, 2020; Haney et al., 2008). Es así que la determinación del dióxido de C (CO2) producto de la actividad biológica del suelo (respiración de C) puede utilizarse como indicador de la salud de un suelo (Haney et al., 2008). Los métodos propuestos para la determinación de la respiración microbiana y del C potencialmente mineralizable (C0) del suelo presentan variaciones principalmente en los tiempos de incubación utilizados. Diversos autores reportaron tiempos de incubación que varían entre 20 días (Beare et al., 1994), 28 días (Haney et al., 2008; Mikha y Rice, 2004) y más de 100 días (Curtin et al., 2014; Franzluebbers, 2020). La necesidad de prolongar los períodos de incubación es particularmente importante para suelos que presentan elevados contenidos de COT y con un alto grado de protección físico-química (Studdert et al., 2017). Esta falta de consenso implica dificultades para la comparación entre trabajos y la determinación del C0, por lo que es de interés conocer cuál es la duración de incubación más adecuada en cada situación. Por otro lado, algunos autores informaron que el C mineralizado (Cmin) en los primeros días de incubación se correlaciona significativamente con el Cmin en incubaciones más largas (Curtin et al., 2014; Franzluebbers et al., 2000), presentándose como una posible alternativa rápida para mostrar el estado de salud del suelo (indicador de salud edáfica) (Franzluebbers, 2016; 2020; Ladoni et al., 2015).
Por lo tanto, para las condiciones edafo-climáticas del SEB se hipotetiza que: 1) para mejorar la estimación del C0 es necesario evaluar la emisión de CO2 durante tiempos de incubación más prolongados que los propuestos por Beare et al. (1994) y Mikha y Rice (2004), y 2) el CO2 emitido durante períodos de incubación más cortos que el establecido para determinar C0 es buen estimador del C0. El objetivo del presente trabajo fue evaluar la emisión de CO2 del suelo bajo diferentes situaciones de uso (sistemas de labranza e IEA) en un suelo del SEB a fin de determinar el período de incubación adecuado para estimar el C0 y evaluar la relación entre C0 y el Cmin en distintos momentos de la incubación para su uso para la estimación de C0 y como posibles indicadores de salud edáfica.
MATERIALES Y MÉTODOS
Sitio y diseño experimentales
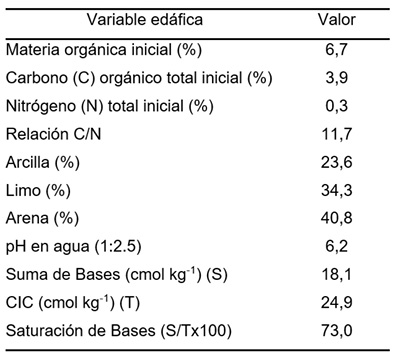
Se tomaron muestras de suelo de un ensayo de larga duración de rotaciones mixtas (cultivos y pasturas) y sistemas de labranza ubicado en la Unidad Integrada Balcarce (UIB, 37º 45’ 09’’ S; 58º 18’ 48’’ O; 140 msnm). El suelo es un complejo de Argiudol Típico (aproximadamente 75%) (Soil Survey Staff, 2014) serie Mar del Plata (INTA, 1979) y Argiudol Petrocálcico (aproximadamente 25%) (Soil Survey Staff, 2014) serie Balcarce (Instituto Nacional de Tecnología Agropecuaria [INTA], 1979) con el horizonte petrocálcico por debajo de los 0,7 m de profundidad, con menos de 2% de pendiente y textura superficial franca, de los cuales se presentan algunas características (Tabla 1). El clima es meso-termal subhúmedo húmedo (Thornthwaite, 1948). La mediana de la precipitación anual y el promedio de la temperatura media diaria son 930 mm año-1 y 14,1 ºC, respectivamente, según datos obtenidos de la Estación Agrometeorológica de la UIB ubicada a 1000 m del ensayo (INTA, 2017).
Tabla 1. Datos analíticos promedio del horizonte superficial de un complejo de suelos, Argiudol Típico (serie Mar del Plata) y Argiudol Petrocálcico serie Balcarce (INTA 1979). CIC: capacidad de intercambio catiónico.
Table 1. Mean analytical data of the surface horizon of a Typic Argiudoll (Mar del Plata series) and a Petrocalcic Argiudoll (Balcarce series) (adaptado de INTA, 1979) soil complex. CIC: cation exchange capacity.
El ensayo fue iniciado en 1976 utilizando labranza convencional (LC) para distintas combinaciones de cultivos y rotaciones con pasturas con base de gramíneas (Studdert et al., 1997). A partir de 1994 y hasta el año de muestreo (2014) hubo tratamientos bajo LC y tratamientos bajo SD (Tourn et al., 2019). En esta etapa del ensayo se definieron distintas combinaciones de periodos bajo cultivo de cosecha y periodos bajo pastura con base de gramíneas y ambos sistemas de labranza (sistemas de cultivo): 1) PP: pastura permanente, 2) 100SD: agricultura continua bajo SD, 3) 100LC: agricultura continua bajo LC, 4) 50SD: rotación 50% del tiempo (3 años) con agricultura bajo SD y 50% bajo pastura (3 años), 5) 50LC: rotación 50% del tiempo (3 años) con agricultura bajo LC y 50% bajo pastura (3 años), 6) 75SD: rotación 75% del tiempo con agricultura (9 años) bajo SD y 25% bajo pastura (3 años), 7) 75LC: rotación 75% del tiempo con agricultura (9 años) bajo LC y 25% bajo pastura (3 años). La secuencia de cultivos para los períodos bajo agricultura fue maíz (Zea mays L.) - soja (Glycine max L. Merr.) – trigo (Triticum aestivum L.). Los cultivos de cosecha recibieron fertilización nitrogenada (60 kg N ha-1 bajo la forma de urea) y fosforada (entre 12 y 20 kg P ha-1 bajo la forma de superfosfato triple de calcio). En el momento del muestreo del suelo 50SD y 50LC se encontraban en el segundo año de uno de los períodos bajo pastura y 75SD y 75LC se encontraban en el quinto año de agricultura luego de un período de pastura. Además, 75SD, 75LC, 100SD y 100LC se encontraban bajo rastrojo de soja. El diseño experimental fue en bloques completos aleatorizados. Más información del ensayo y del diseño experimental se puede observar en Rivero et al. (2020) y en Tourn et al. (2019).
Muestreo, procesamiento de las muestras y determinaciones analíticas
En el otoño de 2014 se tomaron con pala muestras compuestas por 5 sub-muestras de las capas de 0-5 cm y de 5-20 cm, procurando que se generara el mínimo disturbio posible a la estructura del suelo y descartando el suelo que estuvo en contacto con la herramienta. Las muestras de suelo fueron pasadas cuidadosamente, en fresco, por un tamiz de 8000 µm de abertura de malla y se secaron a 40 ºC en estufa con circulación forzada de aire para luego ser almacenadas hasta su utilización.
Para la determinación del COT y CO las muestras fueron molidas en mortero. El COT se determinó por el método de oxidación húmeda con dicromato de potasio en solución de ácido sulfúrico y con mantenimiento de la temperatura de reacción (120°C) durante 90 min (Nelson y Sommers, 1982). Para la cuantificación del COT se midió la absorbancia del sobrenadante a 578 nm con un espectrofotómetro de luz visible Numak 721 (Shanghai Yoke Instrument Co. Ltd., Shanghai, China) y la concentración de C orgánico se calculó a partir de una recta de calibración construida con distintas diluciones de tartrato de sodio 0,5 M. Asimismo, otra alícuota de cada muestra fue sometida a fraccionamiento físico para separar la fracción orgánica asociada a limo más arcilla y la fracción orgánica particulada (> 50 µm) según el método descripto por Cambardella y Elliott (1992). Brevemente, a 10 g de suelo seco y molido se le agregaron 30 mL de una solución de hexametafosfato de sodio (5 g L-1) y se la agitó en un agitador rotatorio durante 16 h. El contenido del recipiente de agitación se volcó sobre un tamiz de 50 µm de apertura de malla y se lo tamizó con ayuda de una corriente de agua desionizada. En el tamiz quedó retenida la fracción arena y el C orgánico particulado (COP). La fracción limo más arcilla más C orgánico asociado a los minerales (COA) fue recogida en un vaso de precipitado. La fracción > 50 µm no fue recuperada y a la fracción < 50 µm se le determinó el COA según fuera descripto para COT. El contenido de COP calculó como la diferencia entre el contenido de COT y el contenido de COA (Cambardella y Elliott, 1992). Los contenidos de COT, COA y COP se expresaron en g C (kg suelo)-1. Se calcularon los contenidos de COT, COA y COP para la capa de 0-20 cm como el promedio ponderado de los contenidos a 0-5 cm y 5-20 cm.
El Cmin se determinó a partir de la cuantificación del CO2 producido en incubaciones aeróbicas en condiciones controladas de temperatura (25°C) y humedad (70-75% humedad relativa del aire) (Beare et al., 1994) por 28 días (Mikha y Rice, 2004). Se incubaron 3 g de suelo molido en recipientes de vidrio de 154 mL de volumen interno provistos de una tapa con cierre hermético y un septo de goma para realizar las extracciones de gases con jeringa. Cada muestra de suelo fue re-humedecida con agua desionizada hasta capacidad de campo (0,03 MPa). Los frascos se incubaron a 25°C ± 1 °C. A los 2, 4, 6, 10, 16, 22 y 28 días de iniciado el ensayo, de cada frasco se extrajeron con jeringa muestras de aire de 10 mL. El contenido de la jeringa se traspasó a tubos de vidrio pre-evacuados (Vacutainer®, Franklin Lakes, Nueva Jersey, Estados Unidos de Norteamérica). En cada momento de extracción y luego de extraer las muestras de aire, los frascos se dejaron abiertos durante 60 min para que se equilibraran las concentraciones de CO2 dentro y fuera (atmósfera) de ellos. La determinación de la concentración de CO2 de cada muestra se realizó inyectando 1 mL en un cromatógrafo gaseoso Shimadzu GC-17A (Shimadzu Corporation, Kyoto, Japón) equipado con un detector de conductividad térmica y una columna GS-Q de 30 m x 0,53 mm. Se utilizó helio como gas transportador y las temperaturas de trabajo de la columna, inyector y detector fueron de 40, 100 y 200°C, respectivamente. Con el valor absoluto de la concentración de CO2 (mL CO2 100 mL aire-1) determinado por el equipo se calculó el Cmin por unidad de masa de suelo (mg C (kg suelo)-1). Los valores de Cmin de cada momento de extracción de aire de los frascos fueron sumándose a los anteriores para obtener el Cmin acumulado hasta cada momento de extracción (Cmin(t), siendo t el tiempo de incubación en días). Con los valores de Cmin(t) se ajustó una ecuación de primer orden para obtener C0 (mg C (kg suelo)-1) y la constante de mineralización de C (k, día-1) como parámetros de ajuste:
Cmin(t) = C0 (1 – e-kt) Ecuación 1
donde t es el día de incubación al que se realizó la extracción de gas de los frascos y representa el período de acumulación de CO2 desde el inicio de la incubación. Para la capa de 0-20 cm los valores de Cmin(t) se calcularon como promedio ponderado por espesor de los valores de Cmin(t) a 0-5 cm y 5-20 cm. El C0 a 0-20 cm se calculó con la Ecuación 1 con los Cmin(t) calculado para 0-20 cm. El C0 se calculó tanto con los datos de Cmin a los 22 días (Cmin(22)) (asemejando el período de incubación propuesto por Beare et al. (1994)) y con los de Cmin a los 28 días (Cmin(28)) (Mikha y Rice, 2004).
A efectos de poner a prueba la primera hipótesis planteada, se realizó un experimento complementario. Este segundo experimento contempló la extensión del tiempo de incubación de los tratamientos más contrastantes (PP, 100SD y 100LC) hasta que la diferencia de emisión de CO2 entre momentos de medición fuera mínima (i.e. meseta).
Análisis estadístico
Se realizaron análisis de varianza, comparaciones de medias (test de Tukey) y análisis de correlación (Pearson) entre variables utilizando el paquete Rcmdr del sistema R (R Core Team, 2018). El modelo estadístico fue un modelo mixto en que los sistemas de cultivo fueron efectos fijos y los bloques, efectos aleatorios. Para algunas comparaciones de medias se utilizaron contrastes ortogonales con el software INFOSTAT (Di Rienzo et al., 2018). El ajuste de la Ecuación 1 se realizó mediante análisis de regresión no lineal utilizando el paquete Stats (función nls) del sistema R (R Core Team, 2018). En todos los análisis estadísticos se consideró un nivel de significación del 5%.
RESULTADOS Y DISCUSIÓN
Carbono orgánico del suelo
Los contenidos de COT, COA y COP se muestran en la Figura 1. Como se esperaba, PP presentó los contenidos más elevados de COT y COP a las tres profundidades (Ernst y Siri-Prieto, 2009; Franzluebbers et al., 2014). Asimismo, las diferencias en el contenido de COT entre sistemas de cultivo fueron debidas, principalmente, a diferencias en el de COP (Diovisalvi et al., 2014; Domínguez et al., 2009; Studdert et al., 2017).
En los tratamientos con predominio de cultivos agrícolas (i.e. 75SD, 75LC, 100SD y 100LC), aquéllos bajo SD (i.e. 75SD y 100SD) mostraron contenidos de COT y COP significativamente más elevados a 0-5 cm (Figura 1a) y 0-20 cm (Figura 1c) que aquéllas bajo LC (i.e. 75LC y 100LC). Por otro lado, los tratamientos con dos años de pastura luego de un período agrícola (i.e. 50SD y 50LC) mostraron mayor contenido de COT y COP en los primeros 20 cm de suelo respecto a aquéllos bajo agricultura continuada (i.e. 100SD y 100LC) y no se diferenciaron entre sí (Figura 1c). No obstante, los contenidos de COT y COP de 50SD y 50LC fueron significativamente menores que los de PP (Figura 1c). Los contenidos de COT y de COP a 0-20 cm no se diferenciaron entre 50SD y 75SD, mientras 100SD mostró significativamente menor contenido de COT que 50SD y 75SD y de COP que 50SD y, además, menor contenido de COP que 75SD (P=0,06) (Figura 1c). A 0-5 cm (Figura 1a) 50SD mostró contenidos de COT y de COP significativamente mayores que los demás sistemas de cultivo bajo SD.
Figura 1. Contenido de carbono orgánico del suelo bajo diferentes sistemas de cultivo (descriptos en el texto) a tres profundidades (0-5 cm (a), 5-20 cm (b), y 0-20 cm (c)). Las barras verticales en cada sección de las columnas indican el error estándar de la media. Letras diferentes dentro de cada sección de las columnas indican diferencias significativas (P<0,05) entre sistemas de cultivo para la correspondiente fracción de carbono orgánico: asociado a la fracción mineral (COA) y particulado (COP). Letras diferentes por encima de las columnas indican diferencias significativas (P<0,05) entre sistemas de cultivo para carbono orgánico total (COT=COA+COP).
Figure 1. Soil organic carbon content under different cropping systems (described in the text) at three soil depths (0-5 cm (a), 5-20 cm (b), and 0-20 cm (c)). Vertical bars in each column section indicate standard error of the mean. Different letters within each column section indicate significant differences (P<0.05) among cropping systems for the corresponding organic carbon fraction: associated organic carbon (COA) and particulate organic carbon (COP). Different letters above the columns indicate significant differences (P<0.05) among cropping systems for total soil organic carbon (COT=COA+COP).
Studdert et al. (2017) reportaron que los contenidos de COT y de COP de suelos similares luego de 11 años de agricultura continua, no presentaron diferencias significativas entre LC y SD, pero sí un descenso en el tiempo. En este estudio, se observaron tendencias similares de disminución del contenido de COT en el tiempo. El contenido de COT a 0-20 cm al inicio del ensayo (1994) fue de aproximadamente 29,7 g kg-1 (Studdert et al., 1997), mientras que, en 2014, estos contenidos fueron 31,9 ± 0,34 g kg-1, 31,8 ± 0,51 g kg-1, y 28,6 ± 0,53 g kg-1, para 50SD, 75SD, y 100SD, respectivamente (Figura 1). En cambio, bajo LC los contenidos de COT a 0-20 cm fueron 31,5 ± 0,31 g kg-1, 27,5 ± 0,42 g kg-1, y 26,9 ± 0,30 g kg-1, para 50LC, 75LC y 100LC, respectivamente (Figura 1). Por tanto, coincidiendo con Powlson et al. (2014) y Studdert et al. (2017), la agricultura continua bajo SD no condujo a secuestrar C en el suelo, por el contrario, produjo una reducción del contenido de COT en el tiempo (Ogle et al., 2019; Puget y Lal, 2005). Por otro lado, la disminución de COT bajo LC ocurrió a mayor tasa (0,14 g kg-1 año-1 vs 0,06 g kg-1 año-1, para 100LC y 100SD, respectivamente). Esto hizo que luego de 20 años bajo agricultura continua, el contenido de COT fuera mayor bajo SD que bajo LC (Figura 1c). Sin embargo, coincidiendo con los resultados de Ernst et al. (2018), la inclusión de pasturas en la rotación condujo a que bajo SD (i.e. 75SD), cinco años de agricultura permitieran lograr mayor contenido de COT que al inicio de la etapa del ensayo bajo estudio y que bajo LC (i.e. 75LC) (Figura 1c).
El principal factor determinante de la dinámica de la materia orgánica del suelo es el aporte de C por los vegetales (Cates et al., 2016; Domínguez et al., 2009; Studdert et al., 2017). El incremento de la frecuencia de pasturas en la rotación lleva a un incremento del aporte de C al suelo, así como un aumento del tiempo en que el suelo está habitado por una elevada masa y densidad de raíces (Franzluebbers et al., 2014; Tourn et al., 2019). Bajo cultivos agrícolas, la dinámica del C orgánico del suelo depende también de cuán protegido esté en la matriz del suelo y de cuánto se lo exponga a la acción de los microorganismos con el laboreo (Six et al., 2004). La labranza produce la ruptura de los agregados y promueve la mineralización de fracciones lábiles de la materia orgánica. En cambio, bajo SD, la no remoción del suelo puede asociarse a una mayor protección del C en los agregados, aunque no siempre se manifieste en secuestro de C en el suelo (Six et al., 2004; Tourn et al., 2019). Los cambios en los contenidos de COT y de COP en respuesta al manejo del suelo, así como su efecto su protección y mineralización, son indicadores del estado de salud del suelo por si mismos (Bünemann et al., 2018). Esta afirmación se basa en las interacciones o relaciones de dichas variables con muchas propiedades del suelo que determinan o reflejan su capacidad de funcionamiento, como, por ejemplo, la actividad microbiológica potencial mediante la emisión de CO2 (i.e. mineralización del C orgánico).
Carbono mineralizado y potencialmente mineralizable
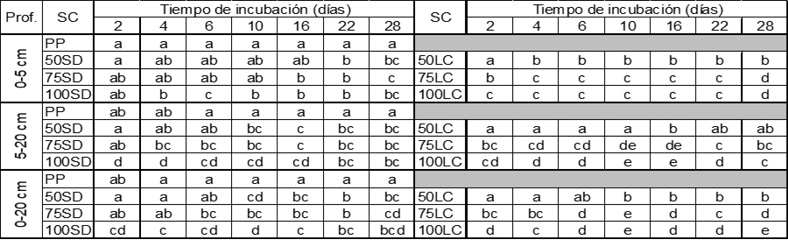
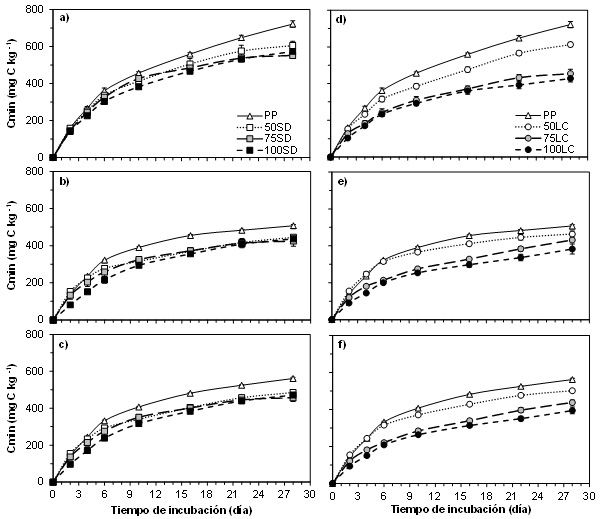
En la Figura 2 se muestra la evolución de los Cmin(t) durante 28 días de incubación para todos los sistemas de cultivo a las tres profundidades. En todos los momentos de determinación del CO2 emitido a las tres profundidades, las diferencias entre sistemas de cultivo fueron altamente significativas (P<0,01). En general, las diferencias en Cmin(t) entre sistemas de cultivo (datos no mostrados) presentaron patrones similares a los de COT y COP (Figura 1). A lo largo de todo el período de incubación los Cmin(t) de PP fueron significativamente mayores que los del resto de los tratamientos. No obstante, en algunos momentos las diferencias con los Cmin(t) bajo 50SD y/o 50LC (bajo pastura al momento de muestreo) fueron no significativas. Coincidiendo con Curtin et al. (2014), el efecto más notorio de las pasturas en el sistema de cultivo se manifestó en la capa de 0-5 cm, posiblemente como consecuencia de la gran acumulación en superficie de material parcialmente descompuesto, propio de las pasturas. Asimismo, el prolongado y continuo crecimiento de las raíces de pasturas de gramíneas cerca de la superficie del suelo (Haynes, 1999), conduciría a una gran producción de compuestos carbonados lábiles que son los que se habrían mineralizado inmediatamente luego de disgregar el suelo para la incubación (Curtin et al., 2014; Ernst y Siri Prieto, 2009). Del mismo modo, independientemente del sistema de labranza, en las situaciones bajo agricultura al momento de la toma de muestras de aire (i.e. 75SD, 100SD, 75LC y 100LC) la emisión de CO2 se vio reducida. En general, los Cmin(t) de los tratamientos bajo agricultura fueron menores que los tratamientos bajo pastura, pero con leves diferencias entre ellos dentro de cada sistema de labranza. Asimismo, las diferencias con los tratamientos bajo pastura fueron más marcadas y significativas bajo LC (i.e. 75LC y 100LC vs PP y 50LC). Bajo SD (i.e. 75SD y 100SD) se observaron Cmin(t) levemente menores que bajo pastura (i.e. PP y 50SD) pero las diferencias fueron significativas mayormente con PP y a partir de los 6 ó 10 d de incubación. Cabe aclarar que en la mayoría de los momentos de determinación a 0-5 cm los Cmin(t) de los tratamientos bajo SD (i.e.75SD y 100SD) no difirieron entre sí, pero fueron significativamente mayores que aquéllos bajo LC (i.e. 75LC y 100LC).
Por su parte, cuando el sistema de labranza fue SD (i.e.50SD, 75SD y 100SD), los niveles de Cmin(t) fueron similares entre sí a todas las profundidades e independientemente de la proporción de pasturas en la rotación (Figura 2). Esto no fue así en los tratamientos bajo LC (i.e.50LC, 75LC y 100LC), en los que se observaron diferencias en Cmin(t) mayormente dadas por la proporción de pasturas en la rotación (50LC > 75LC > 100LC) (Figura 2). La ausencia de diferencias significativas de Cmin(t) en los sistemas de cultivo bajo SD (Figura 2) podría indicar mayor grado de protección de fracciones lábiles de C, respecto a las situaciones bajo laboreo (Tourn et al., 2019). Este efecto, si bien es estratificado (asociado a la acumulación del C en la superficie del suelo dado por la biomasa de residuos de los cultivos y la reducción de la intensidad de la labranza) (Studdert et al., 2017), se observó también a 0-20 cm. (Figura 2).
Figura 2. Evolución del carbono mineralizado acumulado (Cmin) en incubación aeróbica por 2, 4, 6, 10, 16, 22, y 28 días a 25 ºC y a capacidad de campo a tres profundidades (Prof., 0-5 cm (a, d), 5-20 cm (b, e) y 0-20 cm (c, f)) para diferentes sistemas de cultivo (SC, descriptos en el texto). Los gráficos a, b y c muestran el tratamiento con pastura continua (PP) y los SC bajo siembra directa (SD). Los gráficos d, e y f muestran PP y los SC bajo labranza convencional (LC). Las barras verticales indican error estándar de la media (n=3) para cada tiempo de incubación. En la tabla debajo de los gráficos, letras diferentes indican diferencias significativas (P<0,05) entre todos los SC dentro de cada tiempo de incubación.
Figure 2. Evolution of accumulated mineralized carbon (Cmin) during aerobic incubations for 2, 4, 6, 10, 16, 22, and 28 days at 25 ºC and field capacity at three depths (Prof., 0-5 cm (a, d), 5-20 cm (b, e) and 0-20 cm (c, f)) for different cropping systems (SC, described in the text). Plots a, b, and c show the treatment with continuous pasture (PP) and the SC under no-tillage (SD). Plots d, e, and f show PP and the SC under conventional tillage (LC). Vertical bars indicate the standard error of the mean (n=3) for each time of incubation. In the table below the plots, different letters indicate significant differences (P<0.05) among all the SC within each incubation time.
Para la mayoría de los sistemas de cultivo la evolución del Cmin(t) mostró incrementos lineales a partir de, aproximadamente, los 10 días de incubación (Figura 2). Las pendientes de dicho incremento tendieron a diferenciarse entre sistemas de cultivo (datos no mostrados) y en la mayoría de los casos las curvas no tendieron a una asíntota a un valor máximo. Es decir, el Cmin(t) seguiría aumentando más allá de los 28 días de incubación aeróbica, lo que generaría estimaciones poco confiables del potencial de mineralización de estos suelos.
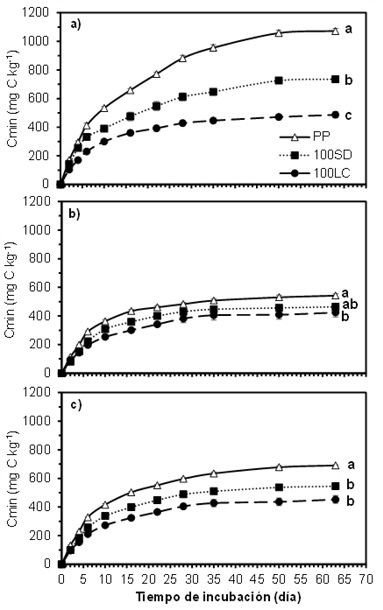
En el experimento complementario con un período extendido de incubación se llegó hasta 63 días de incubación para lograr un incremento insignificante en la emisión de CO2 entre dos determinaciones consecutivas en todos los tratamientos evaluados (Figura 3). La cantidad de C mineralizado acumulado aumentó con la prolongación del tiempo de incubación a las tres profundidades, pero el incremento se mantuvo por más tiempo para PP de 0-5 cm (Figura 3a). Por otro lado, 100LC y 100SD mostraron una estabilización del Cmin(t) con sólo siete días más de incubación respecto al período de incubación propuesto por Mikha y Rice (2004) (28 días), salvo para la profundidad 0-5 cm en 100SD, en la que los Cmin(t) siguieron aumentando hasta los 50 días. Para PP, los aumentos de Cmin(63) respecto a Cmin(28) fueron de 49,0, 12,4 y 27,7% para 0-5, 5-20 y 0-20 cm, respectivamente. En cambio, para 100SD y 100LC, dichos aumentos fueron menores (para 100SD, 30,0, 15,2 y 18,6% y para 100LC, 15,6, 10,8 y 15,1%, respectivamente). Se observaron diferencias significativas entre el Cmin(63) bajo PP y los de los sistemas de cultivo con agricultura continua en las profundidades evaluadas (Figura 3). Bajo PP el Cmin(63) fue, en promedio de las tres profundidades, 1,3 y 1,7 veces mayor que para 100SD y 100LC, respectivamente. Incrementos similares de C mineralizado en situaciones con pasturas permanentes fueron reportadas por Curtin et al. (2014). Estos autores registraron aumentos de hasta 2,5 veces de C mineralizado bajo pasturas respecto a agricultura continua, independientemente del sistema de labranza utilizado. Los autores asociaron este comportamiento a que los aportes de C bajo pastura son mayores que bajo agricultura. Además, el C derivado de las raíces y la rizodeposición hace una mayor contribución al C del suelo que los aportes de la misma cantidad de C por la biomasa área (Katterer et al., 2011), por lo cual podría esperarse que, bajo condiciones de campo, las diferencias en mineralización fueran aún mayores.
Figura 3. Evolución del carbono mineralizado acumulado (Cmin) en incubación aeróbica por 2, 4, 6, 10, 16, 22, 28, 35, 50 y 63 días a 25 ºC y a capacidad de campo a tres profundidades (0-5 cm (a), 5-20 cm (b) y 0-20 cm (c)) para tres sistemas de cultivo (descriptos en el texto). Las barras verticales indican error estándar de la media (n=3) para cada tiempo de incubación. Letras diferentes para el día 63 de incubación a cada profundidad indican diferencias significativas (P<0,05) entre sistemas de cultivo.
Figure 3. Evolution of accumulated mineralized carbon (Cmin) during aerobic incubation for 2, 4, 6, 10, 16, 22, 28, 35, 50, and 63 days at 25 ºC and field capacity at three depths (0-5 cm (a), 5-20 cm (b) y 0-20 cm (c)) for three cropping systems (described in the text). Vertical bars indicate the standard error of the mean (n=3) for each time of incubation. Different letters for the incubation day 63 indicate significant differences (P<0.05) among cropping systems.
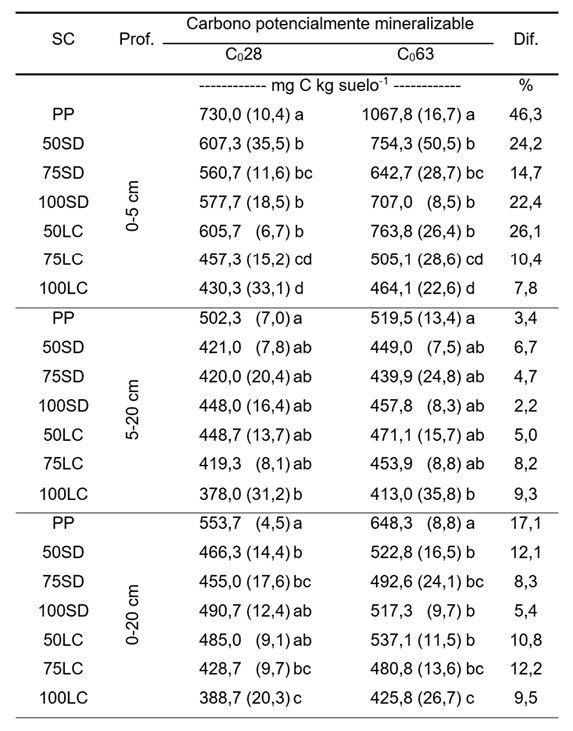
Mediante un modelo polinómico de segundo orden se pudo describir significativamente (P<0,05) y con elevados R2 la relación entre Cmin(63) y Cmin(22) (Figura 4a, b, c) y entre Cmin(63) y Cmin(28) (Figura 4d, e, f) para PP, 100SD y 100LC a las tres profundidades evaluadas. Esto indica, que, para el suelo utilizado en este trabajo, tanto Cmin(22) (similar al tiempo de incubación propuesto por Beare et al., 1994) como Cmin(28) (tiempo de incubación propuesto por Mikha y Rice, 2004) son buenos estimadores del Cmin(63). No obstante, los R2 obtenidos con los modelos relacionando Cmin(63) con Cmin(28), fueron mayores (Figura 4d, e, f). Así, con los modelos cuadráticos mostrados en la Figura 4d, e, y f se estimaron los valores de Cmin(63) para los tratamientos no incluidos en la experiencia complementaria (i.e. 50SD, 75SD, 50LC y 75LC) para 0-5 cm, 5-20 cm y 0-20 cm, respectivamente. De esta forma fue posible calcular (Ecuación 1), el C0 con los Cmin(t) obtenidos hasta los 28 días de incubación (Figura 2) (C028). Por otro lado, se pudo calcular (Ecuación 1) el C0 con los Cmin(t) determinados hasta los 63 días para PP, 100SD y 100LC (Figura 3) y, para 50SD, 75SD, 50LC y 75LC, los Cmin(t) determinados hasta el día 28 (Figura 2) y el Cmin(63) estimado para estos tratamientos con las ecuaciones en la Figura 4e, d, y f (C063). Los resultados de C028 y C063 se muestran en la Tabla 2. Tal como podría vislumbrarse al observar la Figura 2, el cálculo de C0 a partir de los Cmin(t) hasta 28 días condujo a una subestimación de la mineralización potencial de C ya que los valores de C028 fueron menores que los de C063 en proporciones variables entre sistemas de cultivo y profundidades (Tabla 2). Las diferencias entre C028 y C063 estuvieron mayormente explicadas por la mineralización en la capa más superficial del suelo (0-5 cm) (en promedio 21,7 ± 4,8%) y fueron mayores en los tratamientos con pasturas y bajo SD (Tabla 2). En la capa subsuperficial, el aumento promedio fue de 5,2 ± 0,9% y para 0-20 cm fue 10,8 ± 1,4%.
Figura 4. Carbono mineralizado acumulado durante 63 días de incubación (Cmin(63)) en función del mineralizado acumulado durante 22 días (Cmin(22)) (a, b, c) y a los 28 días (Cmin28) (d, e, f) para los sistemas de cultivo pastura continua (PP), agricultura continua bajo siembra directa (100SD) y bajo labranza convencional (100LC) a tres profundidades (0-5 cm (a, d), 5-20 cm (b, e), 0-20 cm (c, f)).
Figure 4. Accumulated mineralized carbon at 63 days of incubation (Cmin(63)) as a function of accumulated mineralized carbon at 22 days of incubation (Cmin(22)) (a, b, c) and at 28 days of incubation (Cmin(28)) (d, e, f) for the cropping systems continuous pasture (PP), continuous cropping under no tillage (100SD) and under conventional tillage (100LC) at three depths (0-5 cm (a, d), 5-20 cm (b, e), 0-20 cm (c, f)).
Tabla 2. Carbono potencialmente mineralizable estimado con el carbono mineralizado durante 28 días (C028) y durante 63 días (tanto medido como estimado) (C063) de incubación, para cada sistema de cultivo (SC) (descriptos en el texto) y a tres profundidades (Prof.). Diferentes letras para cada variable (C028 y C063) a cada profundidad indican que existen diferencias significativas entre SC (P<0,05). Dif.: diferencia porcentual entre C063 y C028. Los números entre paréntesis indican error estándar de la media.
Table 2. Potentially mineralizable carbon estimated from the carbon mineralized during 28 days (C028) and during 63 days (both measured and estimated) (C063) of incubation, for each cropping system (SC) (described in the text) at three depths (Prof.). Different letters for each variable (C028 and C063) at each depth indicate significant differences among SC (P<0.05). Dif.: percent difference between C063 and C028. The numbers between parentheses are standard error of the mean.
La inclusión de pasturas en la rotación aumentó notablemente el potencial de mineralización de C de los suelos, sobre todo a 0-5 cm bajo LC, donde C063 de 50LC ≥ 75LC (Tabla 2). Por su parte, la combinación de SD con rotación con pasturas (50SD y 75SD) llevó a que los tratamientos no se diferenciaran estadísticamente (Tabla 2). El C063 se relacionó significativamente con el C0T (coeficientes de Pearson 0,89, 0,79 y 0,87 para 0-5 cm, 5-20 cm y 0-20 cm, respectivamente, P<0,01) y con el C0P (coeficientes de Pearson 0,85, 0,61 y 0,80, respectivamente, P<0,01). En términos generales, cuanto más elevado fue el contenido de C orgánico del suelo dentro de cada capa (Figura 1), mayor fue la subestimación del cálculo de C0 comparando C028 con C063 (Tabla 2). Por lo tanto, de acuerdo con la forma de las curvas mostradas en la Figura 3, la utilización de los Cmin(63) (tanto los medidos como los estimados según la Figura 4d, e, f) para estimar C063, mejora la aproximación al valor real de C0 respecto al C028. Por lo tanto, para conocer el potencial de mineralización de C de suelos como los utilizados en este trabajo, sería necesario prolongar el tiempo de incubación respecto al propuesto por Mikha y Rice (2004).
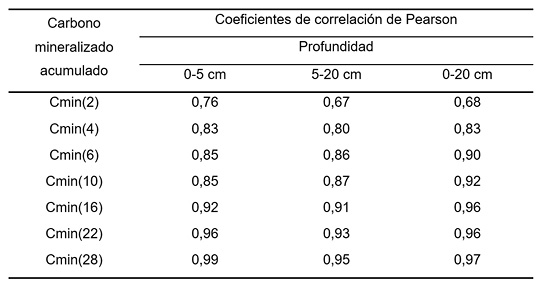
Sin embargo, de acuerdo con los resultados mostrados en la Figura 4, se podría esperar una estrecha relación entre el Cmin(22) y el C063 y entre el Cmin(28) y el C063. En la Tabla 3 se muestran los coeficientes de correlación de Pearson entre C063 y Cmin(22), Cmin(28) y el resto de los Cmin(t) del experimento con el período de incubación hasta 28 días. Todos los coeficientes de correlación de Pearson mostrados en la Tabla 3 son elevados, con rangos entre 0,76 y 0,99, 0,67 y 0,95 y 0,68 y 0,97 para 0-5 cm, 5-20 cm y 0-20 cm, respectivamente. Los coeficientes de correlación de Pearson mostraron un incremento con el aumento de los días de incubación hasta los 28 días. No obstante, los resultados mostrados en la Tabla 3 indican que además de Cmin(22) y Cmin(28), también se podrían utilizar períodos más cortos de incubación como indicadores de la capacidad del suelo de mineralizar C. De esta forma, estas variables podrían considerarse indicadores de actividad biológica y del tamaño de la biomasa microbiana, contribuyendo a la evaluación del estado de salud edáfica (Bünemann et al., 2018; Moebius-Clune et al., 2016). Franzluebbers et al. (2000), Haney et al. (2008), y Moebius-Clune et al. (2018) propusieron la determinación de C02 en incubaciones aeróbicas cortas de suelo seco molido y rehumedecido para la incubación (1, 3, y 4 días, respectivamente), como indicador de la actividad biológica potencial. En coincidencia con Haney et al. (2008), quienes informaron elevada correlación (r = 0,91) entre el C respirado durante un día de incubación con el C02 acumulado en 28 días de incubación, en este trabajo se obtuvieron coeficientes de correlación altamente significativos (P<0,01) entre el C02 emitido a los 2 y a los 28 días de incubación (0,79, 0,57 y 0,64 para 0-5 cm, 5-20 cm y 0-20 cm, respectivamente) y los 4 y los 28 días de incubación (0,85, 0,73 y 0,80, respectivamente). Estos resultados y los mostrados en la Tabla 3 sugieren que, para los suelos bajo estudio, el C02 emitido en incubaciones aeróbicas cortas podría utilizarse como indicador de la actividad microbiana potencial y, así, como indicador de la salud biológica del suelo (Culman et al., 2013; Franzluebbers, 2016, 2020; Ladoni et al., 2015).
Tabla 3. Coeficientes de correlación de Pearson entre el carbono potencialmente mineralizable estimado con el carbono mineralizado acumulado hasta 63 días de incubación (medido o estimado) y el carbono mineralizado acumulado a los 2 (Cmin(2)), 4 (Cmin(4)), 6 (Cmin(6)), 10 (Cmin(10), 16 (Cmin(16)), 22 (Cmin(22)) y 28 (Cmin(28)) días de incubación aeróbica de muestras de suelo tomadas a tres profundidades de diferentes sistemas de cultivo. Todos coeficientes de correlación fueron altamente significativos (P<0,01).
Table 3. Pearson correlation coefficients between potentially mineralizable carbon estimated by the accumulated mineralized carbon up to 63 days of incubation (estimated o measured) and the accumulated mineralized carbon at 2 (Cmin(2)), 4 (Cmin(4)), 6 (Cmin(6)), 10 (Cmin(10), 16 (Cmin(16)), 22 (Cmin(22)), and 28 (Cmin(28)) days of aerobic incubation of soil samples taken at three depths under different cropping systems. All correlation coefficients were highly significant (P<0.01).
CONCLUSIONES
El C0 mostró sensibilidad para distinguir el efecto de prácticas de manejo contrastantes sobre aspectos que hacen a la salud edáfica. Por ello, el C0 podría ser un indicador adecuado de salud del suelo. De acuerdo con los resultados obtenidos, la estimación del C0 mejoró con la prolongación del tiempo de incubación hasta los 63 días. Por lo tanto, la primera hipótesis ha sido respaldada por los resultados. Del mismo modo, se ha demostrado que el C02 emitido en los primeros días de incubación correlacionó bien con el Cmin(28) que es un estimador de C0. Así, la segunda hipótesis también ha sido respaldada por los resultados.
AGRADECIMIENTOS
Este trabajo es parte de la Tesis Doctoral del primer autor en el marco del Programa de Posgrado en Ciencias Agrarias, Facultad de Ciencias Agrarias, Universidad Nacional de Mar del Plata, Argentina. Este trabajo ha sido realizado gracias a la financiación del Fondo para la Investigación Científica y Tecnológica (PICT 2012-1092), la Universidad Nacional de Mar del Plata (proyectos AGR537/17 y AGR570/18) y el Instituto Nacional de Tecnología Agropecuaria (PNCyO 1127032).
REFERENCIAS
Balesdent, J., Chenu, C. y Balabane, M. (2000). Relationship of soil organic matter dynamics to physical protection and tillage. Soil and Tillage Research, 53, 215-230.
Beare, M., Cabrera, M., Hendrix, P. y Coleman, D. (1994). Aggregate-protected and unprotected organic matter pool in conventional and no-tillage soils. Soil Science Society of America Journal, 58, 787-795.
Bünemann, E. K., Bongiorno, G., Bai, Z., Creamer, R. E., de Deyn, G., de Goede, R., Fleskens, L., Geissen, V., Kuyper, T. W., Mäder, P., Pulleman, M., Sukkel, W., van Groenigen, J. W. y Brussaard, L. (2018). Soil quality – A critical review. Soil Biology & Biochemistry, 120,105-125.
Cambardella, C. y Elliott, E. (1992). Particulate soil organic matter. Changes across a grassland cultivation sequence. Soil Science Society of America Journal, 56, 777-783.
Cates, A., Ruark, M., Hedtcke, J. y Posner, J. (2016). Long-term tillage, rotation and perennialization effects on particulate and aggregate soil organic matter. Soil and Tillage Research, 155, 371-380.
Culman, S. W., Snapp, S. S., Green, J. M. y Gentry, L. E. (2013). Short- and long-term labile soil carbon and nitrogen dynamics reflect management and predict corn agronomic performance. Agronomy Journal, 105, 493-502.
Curtin, D., Beare, M. H., Scott, C.L., Hernández-Ramírez, G. y Meenken, E.D. (2014). Mineralization of soil carbon and nitrogen following physical disturbance: a laboratory assessment. Soil Science Society of America Journal, 78, 925-935.
Di Rienzo, J., Casanoves, F., Balzarini, M., González, L., Tablada, M. y Robledo, C. (2018). INFOSTAT. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Córdoba, Argentina.
Diovisalvi, N. V., Studdert, G. A., Reussi-Calvo, N., Domínguez, G. F. y Berardo, A. (2014). Estimating soil particulate organic carbon through total soil organic carbon content. Ciencia del Suelo, 32, 85-94.
Domínguez, G. F., Diovisalvi, N. V., Studdert, G. A. y Monterubbianesi, M. G. (2009). Soil organic C and N fractions under continuous cropping with contrasting tillage systems on Mollisols of the Southeastern Pampas. Soil and Tillage Research, 102, 93-100.
Domínguez, G., García, G., Studdert, G. A., Agostini, M., Tourn, S. y Domingo, M. (2016). Is anaerobic mineralizable nitrogen suitable as soil quality/health indicator?. Spanish Journal of Soil Science, 6, 82-97.
Ernst, O. y Siri-Prieto, G. (2009). Impact of perennial pasture and tillage systems on carbon input and soil quality indicators. Soil and Tillage Research, 105:260-268.
Ernst, O., Dogliotti, S., Cadenazzi, M. y Kemanian, A. (2018). Shifting crop-pasture rotations to no-till annual cropping reduces soil quality and wheat yield. Field Crops Research, 217, 180–187.
Franzluebbers, A. J. (2016). Should soil testing services measure soil biological activity?. Agricultural & Environmental Letters, 1, 150009.
Franzluebbers, A. J. (2020). Soil carbon and nitrogen mineralization after the initial flush of CO2. Agricultural & Environmental Letters, 5, e20006.
Franzluebbers, A. J., Haney, R. L., Honeycutt, C. W., Schomberg, H. H. y Hons, F. M. (2000). Flush of carbon dioxide following rewetting of dried soil relates to active organic pools. Soil Science Society of America Journal, 64, 613-623.
Franzluebbers, A., Sawchik, J. y Taboada, M. (2014). Agronomic and environmental impacts of pasture-crop rotation in temperate North and South America. Agriculture, Ecosystems & Environment, 190, 18-26.
García, G. V., Wyngaard, N., Reussi-Calvo, N. I., San Martino, S., Covacevich, F. y Studdert, G. A. (2020). Soil survey reveals a positive relationship between aggregate stability and anaerobic mineralizable nitrogen. Ecological Indicators, 117, 106640.
Haney, R. L., Brinton, W. H. y Evans, E. (2008). Estimating soil carbon, nitrogen, and phosphorus mineralization from short‐term carbon dioxide respiration. Communications in Soil Science and Plant Analysis, 39, 2706-2720.
Haynes, R. (1999). Labile organic matter fractions and aggregate stability under short-term, grass-based leys. Soil Biology & Biochemistry, 31, 1821-1830.
Hochman, Z., Carberry, P.S, Robertson, M. J., Gaydon, D. S., Bell, L. W. y McIntosh, P. C. (2013). Prospects for ecological intensification of Australian agriculture. European Journal of Agronomy, 44, 109-123.
Instituto Nacional de Tecnología Agropecuaria (INTA). (1979). Cartas de suelo de la República Argentina. Hoja 3757-31 Balcarce, Argentina. http://anterior.inta.gov.ar/suelos/cartas/3757/Balcarce/index.htm.
Instituto Nacional de Tecnología Agropecuaria (INTA). (2017). Registro de datos de la Estación Meteorológica de Unidad Integrada Balcarce. Periodo 1971-2020. INTA-EEA Balcarce. Balcarce.
http://anterior.inta.gov.ar/balcarce/info/meteorologia/meteoro2.htm.
Katterer, T., Bolinder, M., Andren, O., Kirchmann, H. y Menichetti, L. (2011). Roots contribute more to refractory soil organic matter than above-ground crop residues, as revealed by a long-term field experiment. Agriculture, Ecosystems & Environment, 141, 184–192.
Ladoni, M., Basir, A. y Kravchenko, A. (2015). Which soil carbon fraction is the best for assessing management differences? A statistical power perspective. Soil Science Society of America Journal, 79, 848–857.
Lal, R. (2019). Eco-intensification through soil carbon sequestration: Harnessing ecosystem services and advancing sustainable development goals. Journal of Soil and Water Conservation, 74, 55A-61A.
Mikha, M. y Rice, C. (2004). Tillage and manure effects on soil and aggregate-associated carbon and nitrogen. Soil Science Society of America Journal, 68, 809-816.
Moebius-Clune, B. N., Moebius-Clune, D. J., Gugino, B. K., Idowu, O., J., Schindelbeck, R. R., Ristow, A., J., van Es, H. M., Thies, J. E., Shayler, H. A., McBride, M. B., Kurtz, K. S. M., Wolfe, D. W. y Abawi, G. S. (2016). Comprehensive Assessment of Soil Health – The Cornell Framework, Edition 3.2, Cornell University, Geneva, New York, EEUU.
Nelson, D. y Sommers, L. (1982). Total carbon, organic carbon, and organic matter. En: A. L. Page, R. H. Miller y D. R. Keeney (Eds.) Methods of soil analysis. Part 2. 2nd ed. Agronomy Monograph; 9. Am. Soc. Agron. – Soil Sci. Soc. Am., Madison, Wisconsin, EEUU.
Novelli, L., Caviglia, O. y Piñeiro, G. (2017). Increased cropping intensity improves crop residue inputs to the soil and aggregate-associated soil organic carbon stock. Soil and Tillage Research, 165, 168-128-136.
Ogle, S. M. , Alsaker, C., Baldock, J. F., Bernoux, M., Breidt, F. J., McConkey, B., Regina, K. y Vazquez-Amabile, G. G. (2019). Climate and soil characteristics determine where no-till management can store carbon in soils and mitigate greenhouse gas emissions. Scientific Reports, 9, 11665.
Powlson, D., Stirling, C., Jat, M., Gerard, B., Palm, C., Sánchez, P. y Cassman, K. (2014). Limited potential of no-till agriculture for climate change mitigation. Nature Climate Change, 4, 678-673.
Puget, P. y Lal, R. (2005). Soil organic carbon and nitrogen in a mollisol in central Ohio as affected by tillage and land use. Soil and Tillage Research, 80, 201-213.
R Core Team. (2018). R: a language and environment for statistical computing (v. 3.5.2). R Foundation for Statistical Computing, Vienna, Austria. https://www.r- project.org/.
Rivero, C., Tourn, S. N., García, G. V., Videla, C. C., Domínguez, G. F. y Studdert, G. A. (2020). Nitrogen mineralized in anaerobiosis as indicator of soil aggregate stability. Agronomy Journal, 112, 592-607.
Six, J., Bossuyt, H., Degryze, S. y Denef, K. (2004). A history of research on the link between (micro) aggregates, soil biota, and soil organic matter dynamics. Soil and Tillage Research, 79, 7-31.
Sheehy, J., Regina, K., Alakuku., L. y Six, J. (2015). Impact of no-till and reduced tillage on aggregation and aggregate-associated carbon in Northern European agroecosystems. Soil and Tillage Research, 150, 107-113.
Soil Survey Staff. (2014). Keys to soil taxonomy. 12th ed. USDA, Natural Resources Conservation Service. Washington, DC, EEUU.
Studdert, G., Echeverría, H. y Casanovas, E. (1997). Crop-pasture rotation for sustaining the quality and productivity of a typic argiudoll. Soil Science Society of America Journal, 61, 1466-1472.
Studdert, G. A., Domingo, M. N., García, G. V., Monterubbianesi, M. G. y Domínguez, G. F. (2017). Carbono orgánico del suelo bajo sistemas de cultivo contrastantes y su relación con la capacidad de proveer nitrógeno. Ciencia del Suelo, 35, 285-300.
Tourn, S. N., Videla, C. C. y Studdert, G. A. (2019). Ecological agriculture intensification through crop-pasture rotations does improve aggregation of Southeastern-Pampas Mollisols. Soil and Tillage Research, 195, 104411.
Revista científica de la Asociación Argentina de la Ciencia del Suelo