* Autor de contacto: heredia@agro.uba.ar
Recibido:
15-10-21
Recibido con revisiones: 04-04-22
Aceptado:
04-04-22

COMPORTAMIENTO GERMINATIVO DE ESPECIES FITORREMEDIADORAS
DE AMBIENTES EDÁFICOS SALINOS
Mariangeles Vanier 1, Patricia Del Fueyo 1, Andrés Tarditti 1, Olga Susana Heredia 1 2 *
1 Facultad de Agronomía, Universidad de Buenos Aires
2 Instituto Centro de Estudios Transdisciplinarios del Agua
RESUMEN
El aumento de los procesos de salinización de los suelos es una problemática de importancia debido al condicionamiento para la agricultura. En Argentina una zona susceptible se encuentra en el SE de la provincia de Córdoba. En la Pampa Húmeda, la principal fuente de sales es la napa freática. En el campo bajo estudio se localizan zonas marginales con presencia de sales en superficie. El objetivo del trabajo es evaluar el grado de salinización del ambiente e identificar especies viables para una futura fitorremediación, a través del estudio del comportamiento germinativo de especies tolerantes a ciertos rangos de salinidad. Se tomaron muestras de suelo y agua subterránea, en tres sub-ambientes del bajo salino. Se analizó conductividad eléctrica (CE) en pasta de saturación y pH1:2,5 en suelo, pH y CE del agua subterránea. Se realizaron ensayos de germinación con agua subterránea, con las especies: Festuca arundinacea, Thynopyrum ponticum, Lolium multiflorum, Hordeum vulgare y Chenopodium quinoa. Los suelos presentaron pH ligeramente alcalino y CE>2dS m-1, alcanzando valores extremos de 20,9dS m-1 en superficie; la napa freática utilizada estaba a 60 cm de profundidad, con una CE de16,8 dS m-1. La capacidad germinativa fue mayor al 80% para L. multiflorum, F. arundinacea y Ch. quinoa; H. vulgare igual a 67% y Th. Ponticum 50%. Se observó retraso en la germinación según un gradiente de concentraciones salinas. Para la recuperación del ambiente podría utilizarse una mezcla de L. multiflorum, F. arundinacea y Th. ponticum. En ambientes de alta salinidad Ch. quinoa resulta prometedora como especie productora de alimentos.
Palabras claves: conductividad eléctrica, acuífero freático, recuperación de suelos.
GERMINATION BEHAVIOR OF PHYTOREMEDIATE SPECIES OF SALINE
EDAPHIC ENVIRONMENTS
ABSTRACT
The increase in the salinization processes of the soils is an important problem because it conditions agriculture. In Argentina, a susceptible zone is found in the SE of the province of Córdoba. In the Humid Pampa, the main source of salts is the groundwater. In the field under study, marginal areas with the presence of salts on the surface are located. The objective of this work is to evaluate the degree of salinization of the environment and identify viable species for future phytoremediation, through the study of the germinative behavior of species tolerant to certain ranges of salinity. Soil and groundwater samples were taken in three sub-environments of saline lowland soils. Electrical conductivity (EC) in saturation paste and pH1: 2.5 in soil, pH and EC of groundwater were analyzed. Germination tests were carried out with groundwater, using several species: Festuca arundinacea, Thynopyrum ponticum, Lolium multiflorum, Hordeum vulgare and Chenopodium quinoa. The soils presented slightly alkaline pH and EC>2 dS m-1, reaching extreme values of 20,9 dS m-1on the surface; groundwater used was at at 60 cm depth with EC = 16,8 dS m-1. The germination capacity was greater than 80% for L. multiflorum, F. arundinacea and Ch. Quinoa; equal to 67% and 50% for H. vulgare and Th. ponticum respectively. Germination delay was observed according to a gradient of salt concentrations. For the recovery of the environment investigated a mixture of L. multiflorum, F. arundinacea, and Th. ponticum could be used. In high salinity environments Ch. quinoa shows promising as a food-producing species.
Keywords: electrical conductivity, soil recovery, groundwater.
INTRODUCCIÓN
En la región Pampeana más de 19 millones de hectáreas se encuentran afectadas por procesos de salinización, de las cuales un 16% se localizan en la provincia de Córdoba (Gorgas y Bustos, 2008). El Sureste (SE) de la provincia de Córdoba, comprende un área con drenaje deficiente, susceptible al anegamiento y procesos de salinización (Zamolinski, 2000). Estudios de las aguas subterráneas realizados en la provincia de Córdoba, hacen referencia a que en las áreas llanas del SE presenten valores de conductividad eléctrica entre 7 y 30 dS m-1 (Blarasin et al., 2014).
Los cambios en el uso del suelo, el reemplazo de pastizales naturales y pasturas por cultivos anuales, han tenido influencia en la dinámica de las napas freáticas, generando que estas asciendan debido a un menor consumo de agua por parte de los cultivos (Bertram y Chiacchiera, 2013). Relevamientos hidrogeológicos muestran ascensos graduales y persistentes de los niveles freáticos en numerosas áreas de la provincia de Córdoba, en el orden de hasta 10 metros en los últimos 40 años, a pesar de que se presentaron ciclos muy secos en dicho periodo (Blarasin et al., 2014).
La salinización y sodificación de los suelos son procesos que están en continuo aumento (Casas, 2013; Lavado, 2016). Desde el punto de vista biológico, la acumulación de sales en la solución del suelo afecta la disponibilidad del agua para las plantas lo que se conoce como efecto osmótico (Porta Casanellas et al., 2008). La recuperación de los suelos salinos es un proceso lento y dificultoso, que también depende de las condiciones climáticas (Zamolinski, 2000). El mantenimiento de la cobertura vegetal facilita la recuperación de estos suelos; uno de los recursos clave es el uso de plantas forrajeras adaptadas. Además, estos cultivos también son aptos para disminuir el ascenso de los niveles freáticos (Casas, 2013).
Muchas especies vegetales en el estado adulto son tolerantes a las condiciones salinas, sin embargo, son extremadamente sensibles a las sales en la etapa de implantación del cultivo, específicamente durante el proceso de germinación (Weil y Brady, 2017).Este proceso comienza con la absorción de agua por parte de la semilla y finaliza con la emergencia del eje embrionario, comúnmente la radícula, a través de las estructuras que lo rodean, indicando que la semilla ha germinado, esto se conoce también como germinación “sensu stricto” (Bewley et al., 2013). Es a partir de este momento, que se inicia el crecimiento del eje embrionario hasta que se convierte en una plántula que atraviesa y emerge por encima de la superficie del suelo. La forma de medir la capacidad de germinación (potencial de viabilidad) de las semillas de una determinada especie, es a través del porcentaje de semillas que germinan en un tiempo dado. Las semillas en general no germinan en forma simultánea, es por eso que para determinar el potencial de viabilidad se debe observar la emergencia de la radícula repetidamente a lo largo del tiempo. Al graficar el porcentaje de semillas que han completado la germinación en cada momento de ese tiempo, resulta en una curva de germinación en el tiempo, que es característica de cada especie, y además provee gran cantidad de información acerca del comportamiento germinativo o “performance” de esa especie en particular, por ejemplo, revela: el momento, la velocidad, y la uniformidad, entre otros, de la germinación de las semillas (Bewley et al., 2013). Ante procesos de salinización, resulta relevante conocer el comportamiento germinativo de las especies vegetales que pudieran emplearse para recuperación de suelos afectados.
La estrategia de utilizar plantas para recuperar suelos degradados es una tecnología sustentable conocida como fitorremediación. Si bien esta fitotecnología se la asocia más a la recuperación de sitios contaminados, se basa en la capacidad de algunas especies vegetales para tolerar, absorber, acumular y/o degradar elementos presentes en el ambiente. El objetivo de un proceso de fitorremediación es recuperar la calidad del suelo, su funcionalidad (Garbisu et al., 2007).Desde el punto de vista de la recuperación de ambientes salinos, la fitorremediación también se entiende como el cultivo de plantas que puedan ser tolerantes a esas condiciones, para la reducción de la salinidad y/o sodicidad de los suelos (Qadir y Oster, 2002). Por todo esto, la identificación de especies tolerantes permitiría que posteriormente sean utilizadas para fitorremediar suelos afectados por procesos de salinización, contribuir al mejoramiento de las condiciones edáficas y reducir el ascenso del nivel freático.
Este trabajo tiene como objetivos 1) Evaluar el grado de salinización de los suelos y el agua subterránea de un establecimiento ubicado en el sureste de la provincia de Córdoba. 2) Realizar un estudio de germinación para identificar especies fitorremediadoras viables para la recuperación de suelos con problemas de salinización.
MATERIALES Y MÉTODOS
El establecimiento bajo estudio se encuentra en la localidad de Pascanas, departamento Unión, provincia de Córdoba (Figura 1a). Presenta ambientes productivos en las zonas del paisaje correspondientes a loma y media loma, donde, desde hace varios años se viene realizando la siguiente rotación: soja1 (Glycine max (L.) Merr.)/trigo (Triticum aestivum L.)-soja2/maíz (Zea mays L.). El ambiente del bajo no tiene uso productivo, allí se observan algunos sectores con una considerable presencia de sales en superficie y manchones de vegetación halófitas que se han ido estableciendo naturalmente.
Muestro de suelos y aguas
Dado que en la zona del bajo se encontraron distintas situaciones, en cuanto a la cobertura o no del suelo, se determinaron tres sub-ambientes (Figura 1b), uno de ellos dominado por gramón (Cynodon dactylon) (ambiente denominado Ba), otro de los sub-ambientes presentaba Distichlis spicata L. y Basia scoparia L. (ambiente Bb), aquél con eflorescencias salinas presentaba Sarcocornia ambigua y Spergula sp. (ambiente Bc). Se tomaron muestras compuestas de suelo (con barreno) y agua subterránea (freatímetros).
Las muestras de suelo en perfil se tomaron en mayo del 2017, por triplicado según las siguientes profundidades: 0-5, 5-10, 10-20 y cada 20 cm hasta llegar al acuífero libre, luego con los triplicados se realizó una muestra compuesta. La profundidad del acuífero se determinó con una sonda electrónica, y vario según el subambiente de 40-70 cm. Se realizaron mediciones a campo y en laboratorio de pH1: 2, 5 (suelo:agua) y CE1: 1 (suelo:agua) del suelo (según United States Department of Agriculture [USDA], 1999) y en agua según American Public Health Association (APHA, 1992), se utilizó el equipo Lovibond water testing SensoDirect©.
Figura 1. a) Localización del sitio bajo estudio (Ba). b) ubicación de los puntos de muestreo en el ambiente del bajo (Ba, Bb y Bc). Obtenido de Google Earth.
Figure 1. a) Location of the site under study (Ba). b) location of the sampling points in the environment of saline lowland soils (Ba, Bb and Bc). Obtained from Google Earth.
Estudio de germinación
Para esta evaluación, se utilizó una muestra de agua subterránea (AS) del sub-ambiente Ba, cuya CE fue de 16,8 dS m-1y cuya vegetación dominante era gramón. Se trabajó con cuatro tratamientos: muestra de AS al 100% (T100); dilución al 50% AS y 50% agua destilada (T50); dilución AS: agua destilada al 30% (T30), y para el testigo se utilizó agua destilada (T0), se realizaron 5 repeticiones (Tabla1). En cada tratamiento se midió CE, pH, y se determinó el potencial osmótico mediante la fórmula [1]:
[1] Ψo (kPa)= -36 CE (dS m-1)
donde Ψo: potencial osmótico en kPa y CE: conductividad eléctrica en dS m-1.
Se utilizaron semillas de cinco especies: festuca alta (Festuca arundinacea Schreb.) cultivar Baguala INTA, agropiro alargado (Thinopyrum ponticum (Podp.) Barkworth & D. R. Dewey), raigrás anual (Lolium multiflorum Lam.) variedad tetraploide Abundant, cebada forrajera (Hordeum vulgare L.) cultivar Rayen INTA y quinoa (Chenopodium quinoa Willd) cultivar Faro.
Se utilizaron cajas de Petri con doble papel de filtro, en cada una se colocaron 25 semillas, a las cuales se les aplicó una única dosis de 3 mL del tratamiento correspondiente. Las cajas de Petri fueron envueltas en papel de film para evitar pérdidas de humedad. Luego se colocaron dentro de cámara de germinación acondicionadas a temperatura constante de 20ºC para cebada, y temperaturas alternas de 20 a 30ºC para el resto de las especies, según las normas internacionales de ensayos de semillas (International Seed Testing Association [ISTA], 2013). Se trabajó con un diseño completamente aleatorizado. Se evaluó germinación “sensu stricto”, teniendo como criterio de germinación el largo de la radícula mayor a uno o dos milímetros.
La cantidad de días que duró el ensayo para cada especie se estableció según ISTA (2013); festuca alta, raigrás anual y quinoa: 14 días, agropiro alargado: 21 días, cebada forrajera: 7 días. Los recuentos de semillas germinadas se realizaron en forma diaria los primeros días, luego del cuarto día se disminuyó la frecuencia de las mediciones a 48 o 72 h. En cada recuento se retiraron las semillas registradas como germinadas. Se construyeron curvas de germinación en el tiempo, y se determinó la capacidad germinativa de cada una de las especies. Se calculó el porcentaje de semillas de quinoa a las 24 h; de raigrás anual y cebada forrajera a las 48 h; y de festuca alta y agropiro alargado a las 72 h, que hayan emitido radícula superior a los 2 mm. Los datos obtenidos se analizaron estadísticamente mediante análisis de varianza y correlaciones a través del programa INFOSTAT (Di Rienzo et al., 2020).
RESULTADOS Y DISCUSIÓN
Caracterización de los suelos y del agua subterránea
El ambiente del bajo presenta tres sub-ambientes que se diferencian por la cobertura del suelo, vegetación dominante, y/o la ausencia de cobertura. Por este motivo se los identifica como Ba (dominado por gramón) cuya secuencia de horizontes fue A, Bnz, Bnzg y corresponde a un Natracualf molico; Bb (dominado por Distichlis spicata) An, Bnzg y fue clasificado como Natracualf tipico y Bc (costra salina con matas de Sarcocornia ambigua) cuya secuencia de horizontes fue Az-Cz, clasificado como Acuisalid tipico (Figura 1b), los suelos fueron clasificados siguiendo la Soil Taxonomy (Soil Survey Staff-USDA [SSS-USDA], 1998).
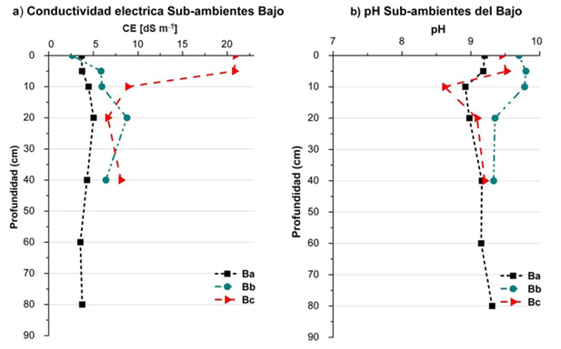
En la Figura 2 se muestra la variación de CE y pH en el perfil del suelo.
Figura 2. Variación en el perfil del suelo de CE (a) y pH1: 2, 5 (b) en los tres sub-ambientes del bajo salino (Ba, Bb y Bc).Figure 2. Variation in the soil profile of CE (a) and pH1: 2, 5 (b) in the three sub-environments of saline lowland soils (Ba, Bb and Bc).
En Ba, la CE se mantuvo cerca de 4,0 dS m-1en casi todo el perfil, solo a los 20 cm se registró un aumento (5,0 dS m-1). El pH se mantuvo cercano a 9 en todo el perfil. En esta zona, la napa freática se encontró a 100 cm de profundidad, con un valor muy alto de CE igual a16,8 dS m-1(Heredia, 2006), y el pH fue de 7,1.
En Bb el suelo presentó CE igual a 2,6 dS m-1en superficie, la salinidad fue aumentando hasta alcanzar los 8,8 dS m-1 a los 40 cm, luego disminuyó manteniendo valores altos de CE. El pH se mantuvo por encima de 9 en todo el perfil, alcanzando el valor máximo de 9,8 a los 10 cm. La napa freática se encontró a 60 cm de profundidad, presentó un valor de CE muy elevado igual a 24,0 dS m-1, y pH igual a 7,2.
El punto Bc se encuentra en la zona dominada por la elevada presencia de sales en superficie, evidenciadas por eflorescencias salinas en superficie. La CE del suelo en superficie fue igual a 20,8 dS m-1 hasta los 10 cm, lo que indica que es un suelo fuertemente salino, luego disminuye con la profundidad, seguramente por efecto de la dilución de las sales por el agua subterránea, el pH en superficie fue igual a 9,4. La napa freática se encontraba a 60 cm de profundidad, con una CE de 30,1 dS m-1.
Los suelos del bajo son salinos-sodicos fuertemente alcalinos desde superficie, presentan valores de CE mayores a 2 dS m-1 alcanzando valores extremos de 20,8dS m-1, y valores de pH1:2,5 mayores a 8,5 (Tarditti et al., 2017). Se trata de suelos halo-hidromórficos; “halo” debido al grado de afectación por la presencia de sales y sodio, e hidromórficos por la influencia del exceso de agua de la napa freática fluctuante (Heredia, 2011). Los valores de CE del agua subterránea de los tres sub-ambientes refleja agua de mala calidad por el riesgo de salinidad que presenta (valores de CE >4 dS m-1) (Heredia, 2006).
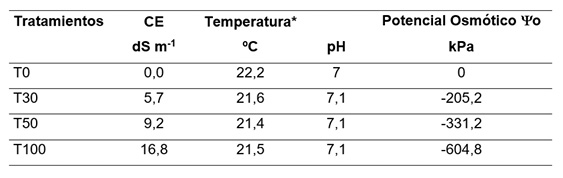
Con la muestra de agua subterránea (AS) del sitio Ba (CE = 16,8 dS m-1) se realizaron los ensayos de germinación. Se eligió este punto debido a que la CE del agua freática era menor al de Bb y Bc cuyas conductividades son prácticamente inviables para las especies forrajeras o agrícolas conocidas, con potencial para la recuperación del suelo. En la Tabla 1 se presentan los valores de CE, pH, y potencial osmótico para la muestra de agua y las diluciones empleadas en los ensayos.
Tabla 1. Determinaciones químicas en el agua subterránea de Ba (T100), sus diluciones (T50 y T30) y el agua destilada (T0). La temperatura corresponde al momento de la medición de pH y conductividad eléctrica (CE).
Table 1. Chemical determinations in groundwater of Ba (T100), its dilutions (T50 and T30) and distilled water (T0). The temperature corresponds to the moment of the pH and electrical conductivity (CE) measurements.
Las sales solubles reducen el componente osmótico (valores más negativos) del potencial agua de los suelos, con lo cual se produce una menor disponibilidad de agua para las plantas (Weil y Brady, 2017). Aún en plantas tolerantes a la salinidad, la germinación es un periodo crítico en el ciclo de vida. Si un exceso de sales impide que la semilla se humecte, el embrión no dispondrá de agua debido a la elevada presión osmótica (Porta Casanellas et al., 2008).
Estudio de la capacidad y comportamiento germinativo
Se estudió la capacidad germinativa, es decir, el porcentaje total de germinación en un momento dado y el comportamiento germinativo en el tiempo de semillas de festuca alta, agropiro alargado, raigrás anual, cebada forrajera y quinoa, con el fin de evaluar las respuestas de cada especie frente a distintas concentraciones salinas. El comportamiento germinativo se registró como germinación acumulada, a partir del recuento periódico para los cuatro tratamientos en las cinco especies.
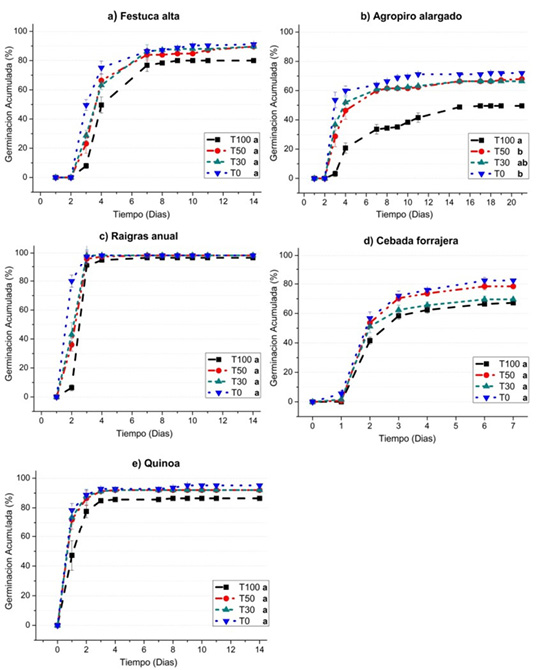
Curvas de germinación en el tiempo: En la Figura 3 se presenta el porcentaje promedio de las semillas germinadas por día, en forma acumulada para cada especie utilizada en los ensayos.
Figura 3. Curvas de germinación acumulada (%) en el tiempo (días) de a) festuca alta, b) agropiro alargado, c) raigrás anual d) cebada forrajera, e) quinoa y su respuesta a las diferentes concentraciones salinas: agua subterránea (T100), dilución al 50% (T50), dilución al 30% (T30), y el tratamiento testigo (T0). Letras distintas indican diferencias significativas entre tratamientos para cada especie (α=0,05).
Figure 3. Accumulated Germination (%) curves over time (days) of a) tall fescue, b) elongated wheatgrass, c) annual rye grass, d) forage barley, e) quinoa and their response to different saline concentrations: groundwater (T100), dilution to 50% (T50), 30% dilution (T30), and the control treatment (T0). Different letters indicate significant differences between treatments for each species (α= 0.05).
Festuca alta: en todos los tratamientos se observó una elevada capacidad germinativa (Figura 3a). Aún en el tratamiento con mayor salinidad (T100) se observó un 80% de semillas germinadas, que si bien es menor a lo registrado en los otros tratamientos (>90%) no se observan diferencias significativas. También se puede observar un retraso en la germinación según el gradiente de salinidad, durante las primeras horas. A las 72 h de iniciado el ensayo, la germinación acumulada (GA) difiere ampliamente entre tratamientos; mientras que en T100 la GA es igual a 8%, en T0 la GA es casi del 50%. Esta diferencia que se observa en los primeros días podría entenderse como un retraso en la germinación, también ocurre en las otras especies ensayadas, por esto, serán analizadas más adelante en la sección porcentaje germinación a las 24, 48 y 72 h de imbibición.
Agropiro alargado: en la Figura 3b se observa una diferencia significativa en cuanto a la disminución del porcentaje de semillas germinadas para T100 (<50%) con respecto a T0 (72%). La reducción de la germinación en condiciones de salinidad puede deberse a que semillas de algunas especies pueden ser inducidas a dormición secundaria, esto ocurre cuando semillas que no tienen barreras para germinar (semillas despiertas) son expuestas a condiciones ambientales desfavorables (Benech-Arnold et al., 2000), como puede ser un bajo potencial agua del suelo. Es un mecanismo que impide que las semillas germinen en ese ambiente inadecuado, y para que este proceso solo ocurra cuando las condiciones sean adecuadas, permitiendo de este modo que las nuevas plantas tengan las máximas posibilidades de supervivencia. Este podría ser el motivo por el cual las semillas de agropiro no se expresaron en su máximo potencial de germinación. A pesar de esto, cabe señalar que el agropiro alargado es una pastura útil para rehabilitar suelos marginales, con problemas de salinidad, alcalinidad y anegamiento, que mejora su capacidad productiva (Casas, 2013; Pesqueira et al., 2017). Debido a su plasticidad fenotípica, se encuentra creciendo espontáneamente en climas húmedos hasta semiáridos (Otondo et al., 2017).
Raigrás anual: En todos los tratamientos se observó un elevado porcentaje de germinación final (Figura 3c), aún en el tratamiento con mayor salinidad se observa más del 95% de semillas germinadas. Además del excelente comportamiento germinativo que presentó esta variedad, se puede destacar que el raigrás constituye uno de los principales verdeos de invierno, y que puede prosperar en suelos donde otras gramíneas perennes no prosperan por falta de niveles adecuados de fertilidad (Carámbula, 1981).
Cebada forrajera: en la Figura 3d puede verse que no hay diferencias significativas entre los tratamientos. Si bien la cebada no es una especie que se cultive en la zona bajo estudio, sino que se trata de un cultivo de zonas más templadas, interesa observar los resultados por ser una especie forrajera con tolerancia a la salinidad.
Quinoa: En todos los tratamientos se observa una elevada capacidad germinativa, aún en el tratamiento con mayor salinidad con más del 85% de semillas germinadas (Figura 3e). Resulta interesante probar la performance en las condiciones ensayadas, debido a la capacidad de tolerar condiciones de alta salinidad edáfica. Por otro lado, el interés en este cultivo está aumentando en todo el mundo, no solo por su tolerancia al estrés osmótico, sino también por su excepcional calidad nutricional (Adolf et al., 2013).
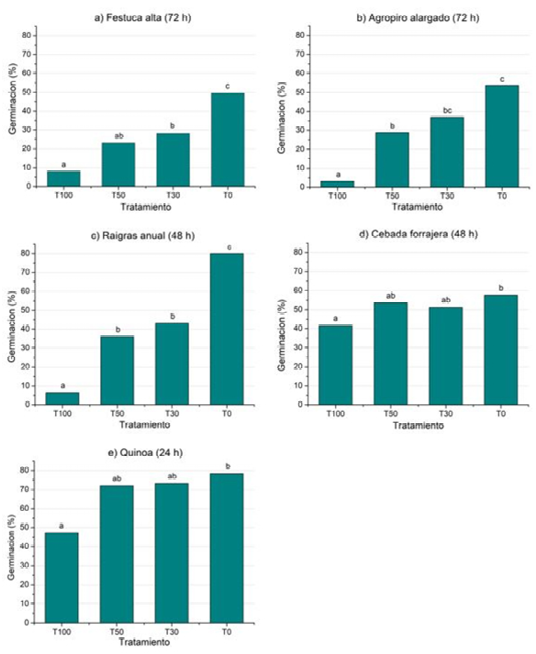
Porcentaje de germinación a las 24, 48 y 72 h de imbibición: Dado que todas las especies mostraron retraso germinativo según el gradiente salino, se decidió evaluar el porcentaje de germinación en las primeras horas de imbibición, a las 24, 48 y 72 h dependiendo de las especies, ya que en ese momento fue donde se observan mayores diferencias de semillas germinadas entre tratamientos para una misma especie (Figura 4).
En la mayoría de los casos, puede observarse diferencias significativas entre tratamientos de una misma especie. En general, se observa que en los tratamientos con mayor salinidad (T100), el porcentaje de semillas germinadas es significativamente menor al tratamiento con mayor dilución (T3) y al testigo con agua destilada.
Figura 4. Porcentaje de germinación de festuca alta (a) y agropiro alargado (b) a las 72 h, raigrás anual (c) y cebada forrajera (d) a las 48 h y quinoa (e) a las 24 h, en función de distintas concentraciones salinas: agua subterránea (T100); dilución al 50% (T50); dilución al 30% (T30); y tratamiento testigo (T0). Letras distintas entre barras indican diferencias significativas entre tratamientos para cada especie (α=0,05).
Figure 4. Percentage of germination of tall fescue (a) and elongated wheatgrass (b) at 72 h, annual ryegrass (c) and forage barley (d) at 48 h and quinoa (e) at 24 h, depending on different saline concentrations: groundwater (T100); 50% dilution (T50); 30% dilution (T30); and control treatment (T0). Different letters among columns indicate significant differences between treatments for each species (α = 0.05).
En el caso de la festuca alta (Figura 4a) se observa diferencia significativa entre los cuatro tratamientos, para T100 se observa un 8 % de semillas germinadas en contraste del 50% en T0. Otra especie que muestra mucha variabilidad entre tratamientos es el raigrás (Figura 4c), en T100 se registra un 6%, mientras que en T0 se observa un 80% de semillas germinadas; T50 y T30 se muestran situaciones intermedias (36 y 43%, respectivamente), sin diferencias significativas entre ellas. Cabe señalar que, al finalizar el ensayo, estas dos especies presentaron una elevada capacidad germinativa en el tratamiento T100 (80% en el caso de la festuca alta, y 97% el raigrás anual) Figuras 3a y 3c.
En quinoa y cebada forrajera (Figura 4e y 4d) si bien hay diferencias significativas entre T100 y T0, siendo T50 y T30 situaciones intermedias, los porcentajes de germinación no presentan tanta variación como sucede con festuca alta, agropiro alargado y raigrás anual (Figuras 4a, 4b y 4c). La quinoa en T100 presentó un porcentaje de germinación igual a 47%, y en T0 igual a 78%, en tanto que para cebada fue de 42% y 58% para T100 y T0 respectivamente. Sin embargo, estas diferencias a las 24 h de imbibición en quinoa y a las 48 h en cebada demostrarían un efecto de la salinidad en el retraso de la germinación en ambas especies.
El retraso de la germinación observado en las distintas especies coincide con lo mencionado por varios autores, la radícula de una semilla resulta particularmente sensible a la salinidad, lo que puede retrasar o incluso impedir la germinación (Weil y Brady, 2017). Por otro lado, el retraso obtenido en la emergencia de la radícula es además proporcional al potencial osmótico, como así lo indica Porta Casanellas et al. (2008). Alcaraz Ariza (2012) señala que el retraso en la germinación ante condiciones desfavorables es una adaptación fisiológica. Siendo especies tolerantes a condiciones salinas, es esperable que no presenten diferencias significativas en el porcentaje final de germinación. Pero al realizar el seguimiento de las semillas germinadas diariamente en las primeras horas, es posible encontrar diferencias tal como se observan en la Figura 4.
El estudio del comportamiento germinativo en las primeras horas permitió reconocer la sensibilidad a la salinidad aún en especies que lograron completar el proceso con una buena “performance” por el alto porcentaje de semillas que germinaron al finalizar el periodo de incubación. En una situación a campo la sensibilidad de las especies podría ser mayor debido a otras condiciones variables, controladas en este ensayo, como puede ser la humedad.
En base a los resultados obtenidos, se sugiere realizar ensayos a campo en el punto del cual se extrajo la muestra de agua, para evaluar la respuesta fitorremediadora de las especies forrajeras ensayadas.
CONCLUSIONES
El ambiente estudiado presenta suelos halo-hidromórficos, con un severo grado de afectación por la presencia de sales provenientes de una napa freática fluctuante, por lo cual tiene importante incidencia en el desarrollo del suelo en los bajos.
El estudio de germinación mostró el efecto de distintos niveles de salinidad en cuanto al retraso de la germinación en todas las especies. A medida que aumenta la concentración de sales, más se evidenció el retraso de la germinación, por la disminución del porcentaje de semillas germinadas en las primeras horas.
El raigrás anual, la quinoa y la festuca mostraron mejor capacidad germinativa en los tratamientos con mayor concentración de sales, teniendo porcentajes de germinación mayores o iguales al 80%. Con estos resultados, podrían ser consideradas como potenciales especies fitorremediadoras de ambientes salinos.
El agropiro alargado a pesar de presentar una capacidad germinativa menor al de las otras especies forrajeras, una vez establecido puede resultar resistente a condiciones de salinidad, con lo cual se propone una estrategia fitorremediadora con diversidad de especies, donde podría ser sembrado en una mezcla con festuca y raigrás anual.
La cebada en la condición más salina tuvo casi un 70% de semillas germinadas. Por lo cual podría ser considerada como una alternativa en suelos salinos de zonas templadas, ya que es una especie que no se cultiva en la zona bajo estudio.
La quinoa mostró una elevada tolerancia a las condiciones de salinidad ensayadas. Teniendo en cuenta un posible establecimiento futuro de este cultivo, permitiría considerarla como una especie prometedora para la producción de alimento de alto valor nutricional en suelos salinizados.
AGRADECIMIENTOS
Proyecto UBACyT 20020130100471BA. A la Srta. B. Stein, FAUBA. Dr. D. Bertero, Cátedra Prod. Vegetal, FAUBA. Dr. D. Batlla, Cátedra de Cerealicultura, FAUBA. Laboratorio de Biología de semillas, FAUBA. A los semilleros que aportaron el material para el ensayo: Ing. Agr. P. Sánchez, Picasso forrajeras– césped. Ing. J. Figueroa Alcorta, Barenbrug, Palaversich.
REFERENCIAS
Adolf, V. I., Jacobsen, S. E. y Shabala, S. (2013). Salt tolerance mechanisms in quinoa (Chenopodium quinoa Willd.). Environmental and Experimental Botany 92, 43-54.
Alcaraz Ariza, F. (2012). Salinidad y vegetación. Geobotánica tema 18, Universidad de Murcia. http://www.um.es/docencia/geobotanica/ficheros/tema18.pdf
American Public Health Association. (1992). Standard methods for the examination of water and wastewater (18th ed.).
Benech-Arnold, R. L., Sánchez, R. A., Forcella, F., Kruk, B. C. y Ghersa, C. (2000). Environmental control of dormancy in weed seed banks in soil. Field Crops Research 67(2), 105-122.
Bertram, N. y Chiacchiera, S. (2013). Ascenso de napas en la Región Pampeana: ¿Consecuencia de los cambios en el uso de la tierra? Informe INTA Marcos Juárez. En: http://inta.gob.ar/sites/default/files/script-tmp-inta_napas_mjz_13.pdf.
Bewley, J. D., Bradford, K. J., Hilhorst, H. W. M. y Nonogaki, N. (2013). Seeds physiology of development, germination and dormancy (3ª ed.). Springer.
Blarasin, M., Cabrera, A., Matteoda, E., Aguirre, M., Frontera, H., Maldonado, I. y Becher Quinodoz, F. (2014). Aspectos litológicos, hidráulicos, cambios de régimen y reservas de los principales acuíferos. Capítulo 1. En M. Blarasin, A. Cabrera, E. Matteoda (Eds.), Aguas subterráneas de la Provincia de Córdoba. (1ª ed.). UniRío Editora. http://www.unirioeditora.com.ar/wp-content/uploads/2020/02/978-987-688-091-6.pdf
Carámbula, M. (1981). Producción de semillas de plantas forrajeras. Editorial Agropecuaria Hemisferio Sur.
Casas, R. (2013). Estrategias para recuperar la producción en suelos salinos. En INTA informa. https://intainforma.inta.gob.ar/estrategias-para-recuperar-la-produccion-en-suelos-salinos/
Di Rienzo, J. A., Casanoves, F., Balzarini, M. G., González, L., Tablada, M. y Robledo, C. W. (2020). InfoStat versión 2020. GrupoInfoStat, FCA, Universidad Nacional de Córdoba. https://www.infostat.com.ar/.
Garbisu, C., Becerril, J., Epelde, L. y Alkorta, I. (2007). Bioindicadores de la calidad del suelo: herramienta metodológica para la evaluación de la eficacia de un proceso fitorremediador. Revista Ecosistemas, 16(2), 44-49.
Gorgas, J. A. y Bustos, M. V. (2008). Dinámica y Evaluación de los suelos de Córdoba con problemas de drenaje, salinidad, y alcalinidad sódica. En E. Taleisnik (Ed), La salinización de suelos en la Argentina: su impacto en la producción agropecuaria (1ª ed.). Editorial de la Universidad Católica de Córdoba.
Heredia, O. S. (2006). El Agua de riego. Criterios de interpretación, efectos sobre el suelo y la producción. En C. Sainato, G. Galindo y O. S. Heredia. Aguas subterráneas. Exploración y utilización agropecuaria. Editorial Facultad de Agronomía, Universidad de Buenos Aires.
Heredia, O. S. (2011). Procesos formadores de los suelos. En M. Conti y L. Giuffré (Eds.), Edafología: bases y aplicaciones ambientales argentinas. (1ª ed.). Editorial Facultad de Agronomía, Universidad de Buenos Aires.
International Seed Testing Association. (2013) International Rules for Seed Testing. Edition 2013.
Lavado R. S. (2016). Características de los suelos salinos y sódicos y su relación con los cultivos. Cómo mejorar la producción forrajera en suelos afectados por sales. Instituto de Investigaciones en Biociencias Agrícolas y Ambientales, Facultad de Agronomía, Universidad de Buenos Aires.
Otondo, J., Borrajo, C. y Bandera, R. (2017). Forrajeras templadas en suelos afectados por las sales de regiones húmedas y subhúmedas de la República Argentina. En E. Taleisnik y R. Lavado (Eds.), Ambientes salinos y alcalinos de la Argentina: Recursos y aprovechamiento productivo (1ª ed.). Orientación Gráfica Editora y Universidad Católica de Córdoba, Facultad de Ciencias Agropecuarias.
Pesqueira, J., Otondo, J. y García, M. (2017). Producción de biomasa, cobertura y calidad forrajera de Chloris gayana y Panicum coloratum en un suelo alcalino sódico de la depresión del salado. Instituto Nacional de Tecnologias Agropecuarias http://ria.inta.gob.ar/sites/default/files/trabajosenprensa/pesqueira-castellano-a-8.pdf
Porta Casanellas, J., López-Acevedo Reguerín, M. y Roquero de Laburu, C. (2008). Edafología: para la agricultura y el medio ambiente. (3ª ed.). Mundi-Prensa.
Qadir, M., y Oster, J. (2002). Vegetative bioremediation of calcareous sodic soils: history, mechanisms, and evaluation. Irrigation Science, 21, 91-101. https://doi.org/10.1007/s00271-001-0055-6.
Soil Survey Staff-USDA. (1998). Keys to soil Taxonomy. (8th ed.).
Tarditti, A. J., Heredia, O. S., Comese, R. y Vanier, M. V. N. (2017). ¿Qué factor influye en la salinidad de los perfiles de suelo? En O. Barbosa y J. Colazo (Comp.) V Reunión de la Red Argentina de Salinidad: salinidad un desafío para el semiárido, Villa Mercedes, San Luis, Argentina, https://redsalinidad.com.ar/wp-content/uploads/2018/11/Trabajos-V-RAS.pdf
United States Department of Agriculture. (1999). Guía para la evaluación de la calidad y salud del suelo. (Luters, A y Salazar Lea Plaza, J. C. traductores) CNR – CNIA - INTA, Argentina.
Weil, R. y Brady, N. (2017). The nature and properties of soils (15th ed.). Pearson Education Limited.
Zamolinski, A. (2000). Experiencias en recuperación de suelos salinizados. Publicación técnica Nº 31. INTA, Centro regional Buenos Aires Norte, Estación Experimental Agropecuaria “General Villegas”.
Revista científica de la Asociación Argentina de la Ciencia del Suelo